Organoides: miniórganos de laboratorio
Hoy os vamos a hablar de una técnica de laboratorio que para el gran público no es muy conocida, pero que supone un gran avance. De hecho, no sería raro que en un futuro a los creadores de esta técnica les fuera concedido el Premio Nobel. No se trata de una técnica absolutamente nueva, puesto que ya en el año 2017 la revista Nature Methods la declaró “método del año”.
¿Qué son?
Básicamente son estructuras tridimensionales creadas en cultivos celulares a partir de células progenitoras extraídas de un órgano (ex vivo) y que mantienen la estructura y el funcionamiento del órgano del que proceden esas células.
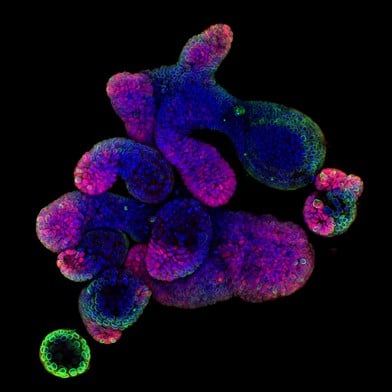
Organoides intestinales (Ilya Lukonin, Friedrich Miescher Institute for Biomedical Research https://www.flickr.com/photos/148881376@N06/47572143961/)
Sin duda alguna, lo más llamativo e increíble es que unas pocas células tengan la capacidad para, en las condiciones adecuadas, construir estructuras de orden superior, para crear “nuevos órganos”. Estas células son células pluripotentes.
La lista de organoides que se han generado ya en laboratorio es muy larga. Así, hay organoides de colon, hígado, páncreas, estómago e incluso de un órgano tan complejo y fascinante como el cerebro.
¿Cuándo se empezó a usar esta técnica?
Es relativamente complicado establecer un primer grupo investigador que empleó esta técnica, puesto que el cultivo tridimensional se lleva a cabo en laboratorio desde hace muchas décadas. Sin embargo, hay un trabajo de 2009 del grupo de Hans Clevers, del Instituto Hubrecht, en los Países Bajos, que se considera fundamental y casi el inicio de esta técnica. Los investigadores estimularon células madre adultas individuales para que formaran estructuras tridimensionales que imitaban a las criptas y vellosidades del intestino delgado.
¿Cómo se genera un organoide?
Vamos a intentar simplificarlo mucho para que se entienda bien.
Lo primero que hay que hacer es tomar una biopsia del tejido a partir del cual se quiere generar un organoide. En esa biopsia hay que separar las células madre adultas (aSCs por sus siglas en inglés, adult Stem Cells). Durante mucho tiempo este fue uno de los pasos más complicados, cómo identificar y separar este tipo de células. El hito en la identificación de estas células madre adultas vino con el descubrimiento del marcador Lgr5 por parte del laboratorio de Hans Clevers. En un principio se identificó esta molécula como un marcador de las células madre adultas del intestino, pero posteriormente se vio que era más universal, puesto que también es marcador de células madre adultas de otros órganos que tienen un origen epitelial.
El siguiente paso es cultivar estas células en el laboratorio. Cada célula madre genera una estructura epitelial organizada que replica, en el caso del trabajo original, la del intestino. Se trata de un cultivo en continuo crecimiento y que se puede mantener a largo plazo. Poco a poco va tomando la forma de las microvellosidades intestinales, con las células especializadas correspondientes. La principal ventaja de los organoides es que son muy estables, tanto genotípica como fenotípicamente. De hecho, se pueden mantener con estabilidad en cultivo en laboratorio durante años.
Utilidad
Imaginad la cantidad de posibilidades que nos da tener pequeñas réplicas de nuestros órganos en un laboratorio. Y recordad que cuando decimos de nuestros órganos no lo hacemos de una manera genérica, sino que efectivamente son de nuestros propios órganos. A partir de una biopsia de mi intestino pueden generar un “mini-intestino” similar al mío en el laboratorio.
- Tratamiento de enfermedades. Se pueden crear organoides a partir de células tumorales de un paciente. Y en ese organoide de origen tumoral se pueden ensayar tratamientos farmacológicos para determinar su eficacia. Esto ayuda a tomar decisiones clínicas, es decir, es una manera de personalizar la medicina, puesto que a partir de las células extraídas del cáncer de un paciente vamos a ser capaces de determinar qué fármaco o combinación de fármacos son los más eficaces para tratar ese tumor y así proceder a tratar al paciente en consecuencia. En definitiva, los organoides constituyen una potente plataforma preclínica. Y no solo para cánceres, como veremos en un ejemplo más adelante.
- Estudio de mecanismos moleculares de enfermedades. La combinación del empleo de organoides con las técnicas de edición génica, como CRISPR, permite diseñar modelos de cáncer introduciendo en células normales diferentes alteraciones en oncogenes y genes supresores de tumores, para así estudiar los mecanismos que provocan un cáncer.
Pero, al igual que en el punto anterior, esta herramienta se utiliza también para estudiar otras enfermedades diferentes al cáncer. Un ejemplo es el caso del autismo, que es un desorden complejo del desarrollo neuronal cuyas causas no se conocen plenamente. Ya hay trabajos en el que los investigadores emplean organoides neuronales creados a partir de células de personas con autismo con el fin de estudiar la importancia de determinados genes en el origen de este desorden.
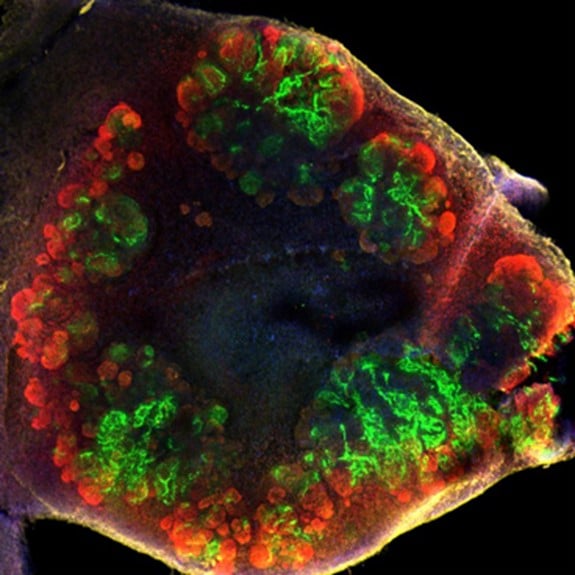
Organoide de riñón (Imagen del Instituto de Bioingeniería de Catalunya, https://ibecbarcelona.eu/for-students/doing-your-phd/inphinit-la-caixa-fellowship-programme/mechanobiology-of-kidney-organoids-derived-from-human-pluripotent-stem-cells/ )
- Estudio del desarrollo embrionario. A partir de células madre embrionarias, en presencia de los estímulos adecuados, estas se autoorganizan en estructuras que forman un gastruloide, que puede seguir las etapas del desarrollo embrionario. Así, por ejemplo, científicos de la Escuela Politécnica Federal de Lausana, en Suiza, publicaron un trabajo en febrero de 2021 en el que daban cuenta de la creación de un organoide que reproduce las primeras etapas de desarrollo de un corazón de ratón. Según los autores, este modelo podría utilizarse para detectar los factores que intervienen en las enfermedades cardíacas congénitas.
De todos estos usos se deprenden varias consecuencias, pero una de las más obvias e inmediatas es la reducción del uso de animales de experimentación. Con esta tecnología se prueban los fármacos directamente en los organoides. De igual modo, las mutaciones que en ocasiones se provocan para conocer el mecanismo de aparición de enfermedades, se hacen ahora sobre estos modelos, en vez de sobre animales.
Vídeo de un organoide de corazón donde se ve a las células latiendo.
Los organoides, sin embargo, aún tienen limitaciones. Expertos, como as investigadoras del IBEC Nuria Montserrat y Elena Garreta, estiman que uno de los principales problemas, como la ausencia de vascularización (estos organoides no tienen vasos sanguíneos, como sí sucede en los tejidos de los que provienen) podría solucionarse con sistemas de microfluidos, de cocultivo o bioimpresión 3D. Esto llevaría a poder disponer de organoides más grandes.
Otra de las limitaciones de los organoides actuales es la ausencia en el laboratorio de las interacciones tejido-tejido. La creación de microambientes que permitan estas interacciones es uno de los retos actuales de la bioingeniería en este campo.
De cómo los organoides ayudaron a salvar la vida de Fabian
No nos gustaría que pensarais que los organoides son otra de esas técnicas que se usan en laboratorio pero que luego tienen poco uso en “la vida real”. Para nada. Ya existen casos concretos, de gente con nombre y apellidos que se han beneficiado de ellos. Para acabar este post, os vamos a contar uno de ellos.
En el año 2012 Clevers fue contactado por Jeffrey Beekman, investigador que pasó por el departamento de Clevers y que en ese momento trabajaba en el Departamento de Neumología Pediátrica de la Escuela de Medicina de la Universidad de Utrecht. Uno de los laboratorios se encarga de estudiar la fibrosis quística, que es una enfermedad hereditaria provocada por un defecto en la proteína CFTR que provoca un mal funcionamiento de los canales iónicos de la célula. Este fallo causa la acumulación de una secreción mucosa espesa en los pulmones que actúa como caldo de cultivo para la bacterias y provoca numerosos problemas respiratorios. Además, también afecta al intestino, provocando diarreas continuas, obstrucciones intestinales y otros problemas. El caso es que Beekman, conocedor de los organoides desarrollados por Clevers, se preguntaba si podían ser una herramienta válida para buscar soluciones para esta enfermedad.
Existe un fármaco, denominado Kalydeco, que actúa “reabriendo” los canales iónicos afectados por la proteína CFTR. Se trata de una medicina altamente eficaz pero que, desgraciadamente, no funciona en todos los pacientes. Esto se debe a que hay unas 2.000 alteraciones genéticas que conducen a sufrir fibrosis quística. De esta manera, si el paciente sufre una mutación que no es una de aquellas frente a las que Kalydeco ha sido probado clínicamente, el tratamiento casi con seguridad no valdrá para nada. Kalydeco, como podéis imaginar, es un fármaco extremadamente caro, unos 25.000 $ cada caja con 56 comprimidos, unos 300.000 $ el año de tratamiento. Al equipo del doctor Kors van der Ent, jefe del laboratorio de fibrosis quística se le ocurrió, junto con Beekman, que sería muy útil poder tener un “mini-intestino” de los pacientes en el laboratorio para así poder probar de una manera barata y sencilla la eficacia del fármaco antes de efectivamente administrárselo al paciente.
A principios de 2015 les llegó el caso de Fabian, un chico con una mutación extremadamente rara que le provocaba la enfermedad. Se trata de una mutación tan rara que solo hay dos casos en el mundo, el suyo y el de su tía. Se desconocía si Kalydeco funcionaba en esta mutación, puesto que no se habían realizado ensayos clínicos con esta mutación, al ser tan exclusiva. El estado de salud de Fabian empezaba a ser crítico, puesto que su función pulmonar era ya solo del 30%. A partir de una biopsia rectal de Fabian crearon organoides de su intestino y probaron Kalydeco en ellos. Vieron, con profunda alegría, que el funcionamiento de los canales iónicos de los organoides volvía a ser normal tras la acción del fármaco Inmediatamente se procedió a tratar a Fabian con Kalydeco y ¡solo cuatro horas! tras administrar el fármaco la mejoría fue evidente. Actualmente Fabian sigue con su tratamiento, pero lleva una vida totalmente normal. Desde este primer caso, ya hay más pacientes con los que se ha realizado el mismo procedimiento.
Comercialización de organoides
En 2013, Clevers ya se había dado cuenta del enorme potencial de los organoides. Era el momento para crear una empresa, una biotecnológica que explotara económicamente esta técnica. Sin embargo, tras largas discusiones con otros colegas científicos, decidieron fundar la Hubrecht Organoid Technology (HUB), una organización sin ánimo de lucro. Esta organización es la que da licencias de uso de su tecnología para el desarrollo de otras aplicaciones en salud. Otro aspecto muy importante de esta organización es la creación y conservación de biobancos. Esto son bancos de tejidos procedentes de personas con diferentes enfermedades que están disponibles para la investigación. De esta manera, a partir de estos tejidos se pueden crear organoides para, por ejemplo, probar fármacos. Así, por ejemplo, ha trabajado con el sistema holandés de salud para crear y mantener un biobanco de pacientes con fibrosis quística y llevar a cabo el mismo proceso que se hizo con Fabian. Y esto es aplicable no solo para el fármaco Kalydeco, sino que los organoides, los miniintestinos se mantienen para probar cualquier droga futura que pudiera aparecer.
Fuentes
https://www.nature.com/articles/nmeth.4575
https://www.cell.com/cell-stem-cell/pdf/S1934-5909(16)30295-8.pdf
https://blog.crownbio.com/hub-organoids-overview
https://www.agenciasinc.es/Noticias/Desarrollado-un-organoide-que-reproduce-el-corazon-embrionario