CAR-NK, una variante de la terapia CAR-T para el tratamiento de tumores
Hace ya cinco años os explicamos en Dciencia lo que era la terapia CAR-T. Si recordáis, la definíamos como una inmunoterapia en los que los linfocitos T del paciente se manipulan genéticamente para que expresen un receptor con capacidad de reconocer una molécula en la membrana celular del tumor (Chimeric Antigenic Receptor) y actúe contra él. Es decir, se trata de coger una de las células del sistema inmune, los linfocitos T y modificarlos para que ataquen específicamente a un tumor.
Pues bien, los científicos se han planteado que existen otras células del sistema inmune que también se podrían emplear como herramientas terapéuticas. En el caso concreto del que os vamos a hablar hoy, las células empleadas son las NK o células Natural Killers.
¿Qué son las células NK?
Las células NK (del inglés natural killer o asesinas naturales) son un tipo de linfocitos producidos en la médula ósea. Se encuentran principalmente en los ganglios linfáticos y circulando en la sangre, pero también son abundantes en tejidos como la piel, el intestino, el hígado, los pulmones… En sangre suponen entre el 5 y el 15% del total de leucocitos.
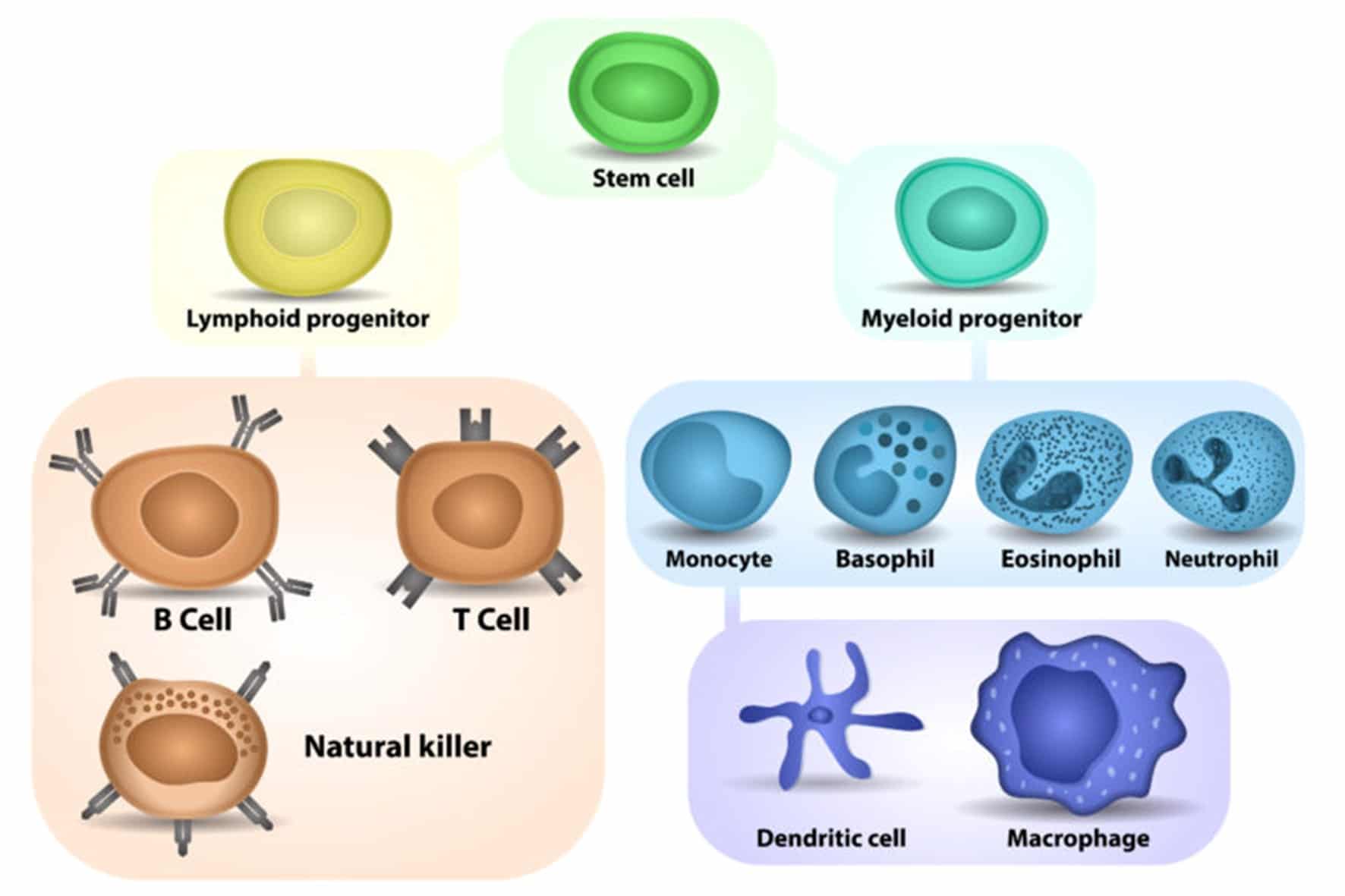
Tomado de https://www.misistemainmune.es/
Tienen un papel esencial en la inmunidad, como podemos ver en individuos que presentan deficiencias en estas células. Estas personas, aunque tengan unos linfocitos B y T totalmente funcionales, sufren infecciones repetidas debidas a virus como el de la varicela zóster o el citamegalovirus. Las células NK realizan su misión defensiva destruyendo las células infectadas por virus y las tumorales sin necesidad de haber tenido contacto previo con antígenos de estas células. Esta actividad “citotóxica” forma parte de la respuesta inmune innata. Además, tienen una segunda actividad que es la citotoxicidad dependiente de anticuerpos. Esto significa que reconocen y destruyen células diana marcadas por anticuerpos. También son capaces de producir grandes cantidades de interferón gama (IFNγ), que potencia la función fagocítica de los macrófagos.
¿Por qué utilizarlas en terapias antitumorales? ¿Qué ventajas tienen?
Se sabe desde hace tiempo que las células NK presentan una potente actividad antitumoral por medio de diferentes mecanismos. De hecho, se considera que constituyen la primera línea de defensa del sistema inmune frente al desarrollo de tumores. Por ello, se piensa que pueden ser una buena herramienta para desarrollar terapias antitumorales similares a CAR-T
La terapia CAR-T presenta un inconveniente importante. Las células que tenemos que usar son las del propio paciente. Es decir, para este tipo de terapia tenemos que extraer del paciente linfocitos T, modificarlos, crecerlos en cultivo y luego volver a introducirlos en su organismo. Es lo que se denomina una terapia autóloga. No se pueden utilizar células T de otro paciente que se modifiquen genéticamente porque esto supone un gran riesgo sufrir la enfermedad de injerto contra el anfitrión, potencialmente mortal. Esta enfermedad consiste en que las células que hemos introducido en el paciente atacan a los tejidos sanos del propio paciente, porque los considera extraños. El hecho de que en CAR-T haya que extraer las células del propio paciente para luego realizar todo el proceso alarga mucho los tiempos de tratamiento (y los costes).
Sin embargo, las células NK sí se pueden administrar a un paciente cuando proceden de otra persona, de un donante. Es decir, podemos hacer terapia heteróloga con este tipo de células porque no se va a producir la enfermedad injerto contra el anfitrión. De este modo, se pueden extraer células NK de, por ejemplo, la sangre del cordón umbilical de neonatos, modificarlas para expresar el receptor quimérico de antígenos tumorales y guardarlas ya listas para su utilización. Obviamente se ahorra tiempo y dinero.
Por otra parte, los resultados de los ensayos clínicos parecen indicar la presencia de menos efectos secundarios que en la terapia CAR-T.
Ensayos en marcha
El año pasado finalizó un ensayo clínico de fase I/II del Centro del Cáncer MD Anderson de la Universidad de Texas, liderado por la doctora Katy Rezvani, en el que se empleaban células CAR-NK anti CD19 para el tratamiento de algunos tumores de la sangre. ¿Qué es eso de CD19? Pues es una molécula que está en la superficie de las células tumorales de los tumores de linfocitos B. Así, esta terapia está en estudio para la leucemia linfoblástica aguda, la leucemia linfocítica crónica y el linfoma no Hodgkin. Además, a las células NK también se les ha introducido el gen de la IL15 (interleucina 15), que básicamente lo que logra es que las células proliferen (haya más células NK modificadas en el cuerpo del paciente) y que sobrevivan más tiempo en el cuerpo del paciente. De hecho, sin este gen las células no sobrevivirían más de dos semanas tras la infusión. Los investigadores han añadido también a las NK un “botón de seguridad”. Se trata de gen suicida inducible. En caso de que se vea que, por cualquier razón, el tratamiento provoca efectos secundarios importante, se puede activar de manera sencilla (administrando un fármaco) este gen y provocar la muerte inmediata de las NK.
Los resultados de este ensayo de fase I/II, publicado en la revista New England Journal of Medicine han sido realmente buenos. Pese a que el ensayo incluía solo once pacientes, en ocho de ellos (73%) se consiguió respuesta al tratamiento. En siete, la respuesta fue completa. Esto significa que, 14 meses después del tratamiento, no mostraban ninguna evidencia de la enfermedad. Además, no hubo efectos secundarios significativos y se comprobó que un año después del tratamiento, las células NK modificadas seguían presentes en el organismo.
En el mismo centro de investigación se está desarrollando un trabajo preclínico encaminado a emplear células NK modificadas genéticamente como tratamiento para el glioblastoma. El glioblastoma es un tipo de cáncer cerebral generalmente bastante agresivo. En este estudio, los investigadores han constatado que las células madre del tumor son sensibles en principio a la acción de las células NK. Sin embargo, también han observado que estas células madre tumorales liberan TGF beta, que bloquea la actividad de los linfocitos NK. Como vemos, los tumores son “listos” e intentan escaparse de las defensas del organismo. En el estudio, publicado en The Journal of Clinical Investigation, han eliminado el receptor para TGF beta de las células NK, de tal manera que pueden seguir activas y atacar al glioblastoma. Este trabajo es muy importante, porque el glioblastoma es el tumor de cerebro más común y agresivo en adultos y además no suele reaccionar bien a los tratamientos.
Como vemos, la terapia CAR-NK es bastante prometedora, aunque aún queda trabajo por hacer.
Artículos originales
- Use of CAR-Transduced Natural Killer Cells in CD19-Positive Lymphoid Tumors. Liu E, Marin D, Banerjee, … , Rezvani K. N Engl J Med 2020; 382:545-553 https://doi.org/10.1056/NEJMoa1910607
- Targeting the αv integrin/TGF-β axis improves natural killer cell function against glioblastoma stem cells. Hila Shaim, … , Amy B. Heimberger, Katayoun Rezvani. J Clin Invest. 2021;131(14):e142116. https://doi.org/10.1172/JCI142116.