Plaquetas artificiales universales, una nueva terapia avanzada
Hoy os vamos a explicar una nueva terapia avanzada. Ya sabéis que intentamos explicaros las nuevas herramientas que desarrollan los científicos para tratar distintas enfermedades. Así, os hemos hablado a lo largo de los años de CRISPR, CAR-T, CAR-NK, inhalación de bacterias, trasplante de heces… Hoy le toca el turno a la terapia con plaquetas universales derivadas de iPSC (induced Pluripotent Stem Cells).
Como siempre, vamos poco a poco.
¿Qué son y para qué valen las plaquetas?
Lo primero es recordaros brevemente lo que son las plaquetas. No son células, sino fragmentos de unas células denominadas megacariocitos. Los megacariocitos son células muy grandes que se forman en la médula ósea. Se caracterizan por tener un núcleo con varios lóbulos y por no tener el número habitual de cromosomas del resto de las células somáticas. Nuestras células somáticas tienen 2n, es decir, dos copias de cada cromosoma, mientras que los megacariocitos pueden tener ¡¡hasta 64n!! Los megacariocitos son células muy curiosas que merecerían un post aparte. En este artículo podéis leer más cosas sobre ellas. Para el post de hoy, nos basta con saber que a partir de estas células se originan las plaquetas. Las plaquetas, también llamadas trombocitos, tienen distintas funciones, pero sin duda la más conocida es su participación en los procesos de coagulación.

Básicamente, si hay una herida que afecte a un vaso sanguíneo, las plaquetas que están circulando por la sangre van a entrar en contacto con el colágeno que hay por debajo del endotelio. El endotelio es la capa de células que recubren un vaso sanguíneo por dentro. Si se rompe el endotelio, queda en contacto con la sangre lo que hay debajo de ese revestimiento, que es una capa con colágeno. Pues, como decíamos, las plaquetas “ven” ese colágeno y se “activan”. Esto quiere decir que liberan los gránulos con sustancias activas que tienen dentro de ellas y se adhieren, se pegan a la herida. Las sustancias que han liberado, entre otras cosas, hacen que vengan más plaquetas y que se “peguen” entre ellas. Las sustancias liberadas también participan en la formación del coágulo por medio de la activación de la fibrina (es un proceso complejo que involucra muchas más sustancias). De esta manera se tapona la herida. En resumen, las plaquetas hacen que las heridas se cierren y dejen de sangrar.

Imagen tomada de https://my.clevelandclinic.org/health/symptoms/21999-hemostasis
Algunas personas sufren trombocitopenia, es decir, presentan un bajo número de plaquetas en sangre. Obviamente esto es importante porque puede hacer que se sufran hemorragias (sangrados) abundantes que pueden ser graves. El tratamiento más común para las trombocitopenias es la transfusión de plaquetas. Sin embargo, el cuerpo puede producir anticuerpos frente a las plaquetas que provengan de un donante, lo cual puede hacer que el tratamiento falle.
¿Qué son las células iPS?
Desde hace ya años se están investigando terapias alternativas a la donación de plaquetas. El grupo del profesor Koji Eto, del CiRA (Center for iPS Cell Research and Application, Centro para la investigación y aplicación con células iPS) de Kyoto, Japón, es puntero en estas investigaciones. Llevan ya varios años trabajando en el desarrollo de plaquetas universales a partir de células iPS. Las células iPS son células madre pluripotentes inducidas. Vamos a explicar todos los términos de su nombre por partes. En primer lugar, son células madre. Esto quiere decir que se trata de células no diferenciadas, que aún no se han convertido en tipos celulares concretos. A partir de las células madre, se generan todos los tipos celulares diferentes y con funciones específicas de un organismo, como los hepatocitos, adipocitos, melanocitos… Además, las células madre se clasifican en función de su potencial. Así, pueden ser totipotentes (pueden dar lugar a un organismo completo), pluripotentes, (dan lugar a las tres capas de un embrión, ectodermo, mesodermo y endodermo), multipotentes (que pueden generar todos los tipos celulares de un solo tejido) o unipotentes (generan un solo tipo celular)

Imagen tomada del artículo MATA-MIRANDA, Maribel; VAZQUEZ-ZAPIEN, Gustavo J y SANCHEZ-MONROY, Virginia. Generalidades y aplicaciones de las células madre. Perinatol. Reprod. Hum. 2013, vol.27, n.3 , pp.194-199. Disponible en: www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S0187-53372013000300009&lng=es&nrm=iso ISSN 0187-5337.
Si os fijáis, hemos dicho que las iPSC son pluripotentes y, si veis la figura, asumiríamos que tienen origen embrionario. Sin embargo, no es así. La explicación a esto viene de la última palabra, inducidas. En el año 2006, el Dr. Yamanaka logró un importante avance, al reprogramar células maduras ya diferenciadas y convertirlas en pluripotentes gracias al empleo de unos factores de transcripción. Es decir, Yanamaka logró inducir la conversión en células madre de células que no lo eran y dotarlas de pluripotencialidad. Por eso se habla de “inducidas”. Yamanaka es actualmente el director del CiRA.
Plaquetas derivadas se iPSC
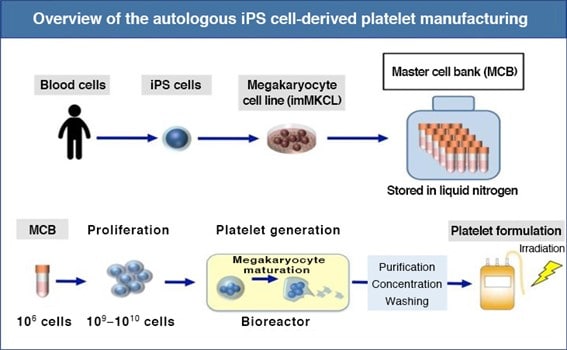
Vale, ya hemos recordado lo que son las plaquetas y hemos aprendido lo que son las iPSC. Vamos a ver ahora en qué consiste la terapia avanzada desarrollada por el CiRA. Partiendo de células iPS humanas, creadas a partir de células somáticas por el procedimiento inventado por Yamanaka, los investigadores lograron crear una cepa de megacariocitos en 2014 (recordad, la célula de la que derivan las plaquetas) inmortalizados. Es decir, estos megacariocitos eran capaces de autorrenovarse in vitro. Estos megacariocitos estaban modificados genéticamente para que se pudiera provocar su maduración, y por tanto la creación de plaquetas, a demanda de los investigadores. Todo depende la presencia o ausencia de un antibiótico, doxiclina, en el medio en el que están los megacariocitos. Si hay doxiciclina, los megacariocitos proliferan. Si se retira, se producen las plaquetas. Muy sencillo, como vemos.
El siguiente paso, en 2018, fue lograr producir la cantidad de plaquetas necesarias para su uso clínico en transfusiones, que es muy elevado. Los investigadores descubrieron que las turbulencias de la sangre actuaban como un regulador físico de la formación de plaquetas en el organismo, in vivo, y lograron simularlo mediante un crecimiento de los megacariocitos en biorreactores de flujo turbulento.

Tomado del artículo https://www.cell.com/cell/fulltext/S0092-8674(18)30736-0

Bien, ya habían logrado un stock inmortal de megacariocitos y una cantidad apropiada de plaquetas para realizar transfusiones. ¿Qué faltaba? Pues rizar un poco el rizo. Recordad que más arriba hemos comentado que la transfusión de plaquetas, en un porcentaje de casos podía haber rechazo, el organismo del receptor podía generar una respuesta inmunitaria frente a las plaquetas. Una solución a esto podría ser la trasfusión de plaquetas autólogas, es decir, realizar todo el proceso anterior a partir de células del propio paciente. Bien, esto obviamente retrasa los tiempos, es caro y además se obtienen plaquetas de calidad variable. La solución por la que han optado Eto y su equipo es más creativa. Sabían, por trabajos previos de otros grupos, que la mayor causa de rechazo de los trasplantes de plaquetas es la formación de anticuerpos frente a HLA-I. Es parecido a los grupos sanguíneos. Para que no haya rechazo hay que buscar un HLA-I compatible entre el receptor y las plaquetas del donante. Los científicos japoneses lo que hicieron entonces fue generar iPSC a las que, por medio de la tecnología CRISPR, les habían eliminado esta molécula. A partir de esas iPSC modificadas genéticamente generaron los megacariocitos inmortalizados y a partir de ellos las plaquetas. Las probaron en ratones y vieron que, efectivamente no había rechazo mediado por anticuerpos, pero tampoco mediado por las células NK, que era otro problema que había cuando experimentos anteriores habían intentado eliminar HLA por medio de otras técnicas.

Tomado del artículo https://www.cell.com/stem-cell-reports/fulltext/S2213-6711(19)30414-X
De esta manera, el grupo de Eto ha creado lo que se denominan como “plaquetas universales iPS HLA deplecionadas”. En resumen, lo que han logrado ha sido crear en un laboratorio unas células que se pueden mantener y servir como “stock” para, a partir de ellas, fabricar plaquetas que valen para, a priori, cualquier paciente y además hacerlo en cantidad suficiente como para puedan ser utilizadas en trasplantes.
Usos
Estas plaquetas se pueden emplear en casos refractarios a la trasfusión de plaquetas debidos a la incompatibilidad provocada por HLA. Gracias a los biorreactores de flujo turbulento se pueden obtener cantidades enormes para llevar a cabo las transfusiones. Esto abre la puerta a todos aquellos pacientes que tengan una trombocitopenia refractaria a las transfusiones.
De hecho, el CiRA juntamente con el Hospital Universitario de Kyoto ha llevado a cabo un ensayo clínico con un solo paciente. Este paciente tenía anemia aplásica y además era refractario a las trasfusiones de plaquetas (no funcionaban en él). En el ensayo, el paciente recibió trasfusiones de plaquetas iPS autólogas en un estudio de escalado de dosis. Las plaquetas se generaron a partir de células iPS del propio paciente utilizando el método que hemos contado para generar megacariocitos y empleando un biorreactor turbulento. Determinaron la seguridad del tratamiento y posteriormente la eficacia. Han completado ya un año de seguimiento con resultados positivos.
Artículos originales de la investigación:
- Ito Y, Nakamura S, Sugimoto N, Shigemori T, Kato Y, Ohno M, Sakuma S, Ito K, Kumon H, Hirose H, Okamoto H, Nogawa M, Iwasaki M, Kihara S, Fujio K, Matsumoto T, Higashi N, Hashimoto K, Sawaguchi A, Harimoto KI, Nakagawa M, Yamamoto T, Handa M, Watanabe N, Nishi E, Arai F, Nishimura S, Eto K. Turbulence Activates Platelet Biogenesis to Enable Clinical Scale Ex Vivo Production. Cell. 2018 Jul 26;174(3):636-648.e18. https://www.cell.com/cell/fulltext/S0092-8674(18)30736-0
- Nakamura S, Sugimoto N, Eto K. Ex vivo generation of platelet products from human iPS cells. Inflamm Regen. 2020 Dec 1;40(1):30. https://inflammregen.biomedcentral.com/articles/10.1186/s41232-020-00139-2
- Suzuki D, Flahou C, Yoshikawa N, Stirblyte I, Hayashi Y, Sawaguchi A, Akasaka M, Nakamura S, Higashi N, Xu H, Matsumoto T, Fujio K, Manz MG, Hotta A, Takizawa H, Eto K, Sugimoto N. iPSC-Derived Platelets Depleted of HLA Class I Are Inert to Anti-HLA Class I and Natural Killer Cell Immunity. Stem Cell Reports. 2020 Jan 14;14(1):49-59. https://www.cell.com/stem-cell-reports/fulltext/S2213-6711(19)30414-X
- Sone M, Nakamura S, Umeda S, Ginya H, Oshima M, Kanashiro MA, Paul SK, Hashimoto K, Nakamura E, Harada Y, Tsujimura K, Saraya A, Yamaguchi T, Sugimoto N, Sawaguchi A, Iwama A, Eto K, Takayama N. Silencing of p53 and CDKN1A establishes sustainable immortalized megakaryocyte progenitor cells from human iPSCs. Stem Cell Reports. 2021 Dec 14;16(12):2861-2870. https://www.cell.com/stem-cell-reports/fulltext/S2213-6711(21)00554-3







