Novedades sobre CRISPR
Hace ya casi dos años que en este mismo blog escribimos sobre la tecnología CRISPR/Cas9. Recordemos que se trata de una tecnología que permite editar genomas de cualquier especie. Es decir, cambiar la secuencia del ADN casi a voluntad. En el post resumen del año 2014 consideramos que la consolidación de la tecnología CRISPR había sido uno de los hitos científicos del año. Bien, parece que nos adelantamos un poco, porque ahora es cuando realmente está de moda.
Vamos a ver qué ha pasado en estos dos años. Cómo ha evolucionado CRISPR/Cas9 y si ya se usa de manera habitual y para qué.

ABREVIANDO EL NOMBRE… Y MEJORANDO LAS PRESTACIONES
La tecnología ha ido evolucionando ella misma. De hecho lo está haciendo de manera continua. Ya todo el mundo la conoce como tecnología CRISPR, abreviando y eliminando Cas9. Lo que en principio era solo economía del lenguaje se ha convertido en algo muy acertado. Si recordáis, comentábamos que la molécula CRISPR se une a una secuencia específica del ADN. Guía entonces a una enzima, Cas9 que corta en ese punto, a modo de tijeras moleculares. A partir de ahí se reparaba la cadena de ADN sin más o se añadía más material genético antes de la reparación. Uno de los grandes peros a la tecnología es que Cas9 no es siempre preciso. Los investigadores han encontrado ya 6 tipos diferentes de sistemas CRISPR con hasta 19 subtipos (y se cree que solo se conoce una fracción). Bien, se trabaja ya en los laboratorios con otra proteína, Cpf1, La principal diferencia es que Cas9 genera lo que se llaman “extremos romos” en el corte que hace en el ADN, mientras que Cpf1 lo hace dando lugar a “extremos cohesivos” (aquí tenéis una explicación de lo que son extremos romos y cohesivos). Hace muy poco, en diciembre de 2016, científicos de Berkeley han publicado un artículo en el que utilizan nuevas enizmas, CasX y CasY que se supone mejoran aún más la tecnología.
Conclusión: a partir de ahora podemos hablar de la tecnología CRISPR a secas (o herramientas CRISPR), y sobre ese nombre añadiremos los apellidos según la enzima que se use en cada momento. Además, se están dando pasos continuos para mejorar la herramienta, haciéndola más precisa y eficaz.
BLOQUEO DE CRISPR
A finales de diciembre de 2016 se publicó en la revista Cell el descubrimiento de una manera de inactivar el sistema CRISPR/Cas9, empleando para ello unas proteínas de bacteriófagos. En principio podemos pensar ¿y esto para qué vale? ¿Para qué quiero bloquear el sistema que me permite editar un genoma? Estas nuevas proteínas “antiCRISPR” ayudarán a tener un control más preciso de las aplicaciones de la técnica y también pueden servir para bloquear de manera rápida usos potencialmente dañinos de la tecnología. Recordemos que el principal problema de CRISP/Cas9 es que no es todo lo preciso que debiera. Estos inhibidores podrían, en un futuro, mejorar la precisión de la edición genómica.
¿PARA QUÉ SE HA UTILIZADO YA?
Lo primero que hay que dejar bien claro es que aún no hay ninguna terapia disponible que emplee la tecnología CRISPR. Sí se ha utilizado ya con bastante éxito en modelos tanto celulares como animales. A continuación citamos solo algunos ejemplos llamativos:
- Evitar que los champiñones se vuelvan marrones al contacto con el aire. Investigadores de la Penn State University desactivaron el gen de la polifenol oxidasa de los champiñones, logrando así que el pardeamiento se retrase en el tiempo. Bien, no va a cambiar de manera relevante nuestra vida, pero sí puede contribuir, por ejemplo, a que se deseche menos comida porque su aspecto se haya deteriorado.
- Cáncer de pulmón. A finales de octubre de 2016 un equipo de científicos chinos delecionó (eliminó) un gen de unos linfocitos de un paciente de cáncer de pulmón y reinyectó estas células editadas en el paciente, en el primer ensayo clínico del mundo con CRISPR.
- Primer ensayo clínico de CRIPSR en Estados Unidos. El 21 de junio de 2016 el Instituto de Salud de Estados Unidos (NIH) dio luz verde a un ensayo que proponía el empleo de CRISPR en células T del sistema inmune de 18 pacientes, con el fin de modificarlas y hacerlas más eficaces en la destrucción de las células tumorales. La modificación consiste en tres abordajes diferentes: 1. Inserción de un gen que codifica para una proteína que detecta a las células tumorales. 2. Eliminación de un gen que codifica para otra proteína que interfiere con la detección de las células tumorales. 3. Eliminación de un gen que codifica para una proteína que identifica a las células T como células del sistema inmune y evita que las células tumorales las inactiven.

Célula T del sistema inmune (azul) atacando a una célula tumoral (rosa). Tomado de STEVE GSCHMEISSNER/SPL en www.nature.com
- Anemia falciforme. En noviembre de 2016 se publicó un artículo en el que se editaban células madre de la médula ósea de personas con anemia falciforme. Estas células posteriormente se trasplantaban en ratones para ver si sobrevivían y daban lugar a células sanguíneas sanas. Pasados cuatro meses las células madre seguían perfectamente vivas en la médula ósea de los ratones.
- Enfermedad granulomatosa crónica. Es una enfermedad rara que afecta a 25.000 personas en todo el mundo. Se trata de un desorden genético con pocas alternativas terapéuticas y que hace que los pacientes tengan una mayor susceptibilidad a las infecciones. Está provocada por defectos en la proteína NOX2, esencial para el sistema inmune. Investigadores de Estados Unidos lograron reparar por medio de CRISPR/Cas9 la mutación de NOX2 en células madre de pacientes de esta enfermedad y confirmaron que eran capaces de diferenciarse en células del sistema inmune con sus habilidades antibacterianas restablecidas.
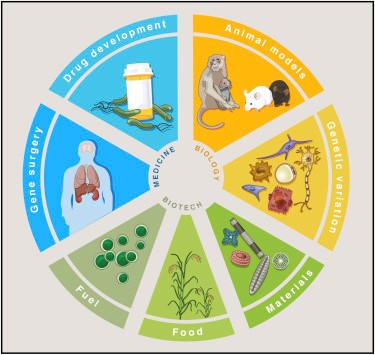
Campos de uso de la tecnología CRISPR.
Tomado del artículo Development and Applications of CRISPR-Cas9 for Genome Engineering de Patrick D. Hsu, Eric S. Lander, Feng Zhang en Cell.
- Producción de precursores de polímeros, adhesivos, fragancias y biofuel. Un equipo de la Universidad de California ha empleado la tecnología de CRIPSR/Cas9 para modificar determinadas levaduras y así lograr que produzcan una serie de lípidos y polímeros a partir de azúcares. De esa manera se evita partir de derivados del petróleo, que es lo que se usa actualmente para fabricar las sustancias anteriormente nombradas.
- Creación de líneas celulares “a medida” con fines de investigación. La empresa Horizon Discovery, del Reino Unido utiliza la tecnología CRISPR para crear estas líneas celulares “especiales”. Además, están desarrollando, junto con la empresa también británica Solentim, una plataforma automatizada de fabricación para la edición genética de líneas celulares de mamíferos. Dicho de otra manera: una manera rápida y barata de fabricar líneas celulares con su genoma editado.
ASPECTOS ECONÓMICOS Y LEGALES
Según el informe «Global CRISPR/Cas9 Market Outlook 2022» se estima que el mercado global de la tecnología CRISPR/Cas9 superará los 1.500 millones de dólares en 2022. Se prevé un fuerte crecimiento del mercado gracias, fundamentalmente a la expansión de su aplicación en el descubrimiento de fármacos así como en otras actividades terapéuticas. Pero antes de llegar a todo esto, hay que tener en cuenta como se soluciona el conflicto de patentes del que ya hablamos en el post anterior.
A finales de diciembre de 2016 un panel de jueces de la Oficina de Patentes y Marcas de Estados Unidos en Virginia (EEUU), escuchó los alegatos sobre quién debería poseer los derechos sobre el sistema de edición génica CRISPR-Cas9. Se espera su decisión para los primeros meses de 2017. Recordemos que se trata de una batalla legal entre el Instituto Broad del Instituto Tecnológico de Massachusetts (MIT) y la Universidad de Harvard, que tienen 13 patentes relacionadas con CRISPR, y por otro lado, la Universidad de California en Berkeley, que se considera la inventora real de la tecnología. Aquí tenéis un vídeo que explica muy bien la guerra de patentes (en inglés).
¿De qué se trata esta guerra? Pues no nos engañemos, básicamente de miles de millones de euros asociados a acuerdos comerciales con empresas de diversos sectores, desde el sector médico-farmacéutico hasta el agrícola. Así, el Instituto Broad ha concedido derechos de licencia exclusiva para emplear la tecnología CRISPR a Editas Medicine para que desarrolle tratamientos médicos y a Monsanto para el campo agrobiotecnológico. La Universidad de Berkeley ha hecho lo propio (con licencias y sublicencias) con otras empresas como Intellia Therapeutics, CRISPR Therapeutics y Caribou Biosciences (ésta a su vez ha negociado con DuPont para los temas de biotecnología agraria). Entre todas estas empresas han logrado rondas de financiación de capital riesgo por unos 1.000 millones de euros. Sea cual sea la decisión de los jueces parece ser que las empresas, unas u otras, se verán obligadas a renegociar sus acuerdos… con las consiguientes posibles pérdidas económicas para unas y ganancias para otras. Probablemente todo se reorganice por medio de sublicencias para campos o fines concretos. Pero, ojo, es muy importante tener en cuenta que esta guerra de patentes se refiere solo a CRISPR/Cas9, a esa enzima en concreto… no a todo el sistema CRISPR.
En este punto es importante resaltar también que la FDA americana ha decidido regular la tecnología CRISPR como si se tratase de un fármaco. El argumento esgrimido para ello es que CRISPR provoca una modificación química de la célula, de igual modo a lo que hace un fármaco.
RESUMEN
A día de hoy, CRISPR se ha convertido en una poderosa herramienta de laboratorio. Debido a su relativamente bajo precio y su también relativa facilidad de uso ha sido adoptada por miles de laboratorios de todo el mundo. Sin embargo, aún no se ha convertido en una técnica que transforme la práctica médica. Básicamente porque en investigación dos años no es casi nada para que aquello que se hace en los laboratorios se transfiera a la clínica, agricultura o industria. Pero no hay que dudar de que ese momento llegará, antes casi de que nos demos cuenta.
PS: Recordemos que el origen de esta tecnología que cambiará nuestras vidas parte de un descubrimiento español, el de las secuencias CRISPR en bacterias realizado por el español Francisco Martínez Mójica, de la Universidad de Alicante. En este artículo revisa cómo fue el descubrimiento. Y éste es el artículo original del descubrimiento.

About the Author: Alberto Morán
16 Comments
Leave A Comment Cancelar la respuesta
Este sitio usa Akismet para reducir el spam. Aprende cómo se procesan los datos de tus comentarios.








Muy buen articulo, he leido por ahi sobre el uso de esta tecnica para implantar genes humanos en animales, que pudiera servir para donacion de organos, aunque no se que tan cierto sea esto. De nuevo muy buen articulo, se agradece.
Muchas gracias, nos alegramos de que te haya gustado. Las utilidades de este técnica a priori son casi infinitas, solo el futuro nos dirá cuáles son realmente viables y cuáles no.
[…] Novedades sobre CRISPR (dciencia.es) […]
Son más rápidos en actuar los «enlentecedores» de descubrimientos que abren caminos para la cura de enfermedades que los burócratas de turno. Hay que recordar los «saltos express» que se dieron con el ébola y si no me equivoco con el VIH en los protocolos de investigacion clínica. ¿Qué ha pasado con la vacuna contra el cáncer de pulmón de manufactura cubana?., ¿Cuántas enfermedades se han curado desde el descubrimiento de la penicilina»?,¿Tendremos que esperar a los más listos del planeta Tierra, es decir, a los … que se ha autoproclamado o proclamados por sus amigos de toda la vida, la quintaesencia del bien y del mal que deberán de interrumpir y con ello…… millones de vidas en pos de una ética deontológica que nadie la ha pedido para salvar vidas (en realidad no sabía que habia que discutir para salvar vidas) y que cada uno tiene una ética u opinión, como el …..?.
Un saludo
Podría usarse esta tecnología en distrofias musculares como la de Duchenne?
La DMD está causada por alteraciones en el gen de la distrofina. Algunas de esas mutaciones son deleciones extensas, para las que podría ser complicado utilizar este técnica, aunque no imposible. Pero hay hasta un 30 % de casos en los que lo que se produce son mutaciones puntuales. Para estos casos sí se podría usar claramente la edición génica con CRISPR.
[…] Naturalmente las lecturas de unos artículos te llevan a otros y más uno lee, más espeluznante resulta hasta donde está llegando la ciencia y lo que no sabremos, supimos hace unos años se clonaron todo tipo de animales y hasta podría ser humanos, quién sabe, pero con lo conocido ya, igual ni haría falta la clonación, y ahí aparece la tecnología CRISPR/Cas9. […]
Muchas gracias por tu articulo y por tu nivel de divulgación científica. Soy profesora de Biologia en un instituto y es muy importante poder articulos de actualización para estar al dia y dar a conocer de forma simple los avances en biotecnologia i biomedicina a mis estudiantes. Mi pregunta es si, para reparar mutaciones extensas seria posible aplicar esta tecnologia a nivel de embriones humanos, siempre teniendo en cuenta la legalidad vigente, o a nivel de cultivos cel.lulares de un paciente para utilitzar posteriormente com traspante (terapia génica).
Muchísimas gracias a ti por tu comentario y por la labor que hacéis los profesores en los institutos. De vosotros depende en gran medida que surjan vocaciones científicas, sois los que más marcáis a los alumnos en una etapa esencial de la vida. Paso a responder tu pregunta. A ver.Teóricamente sí se podría… pero en la práctica el problema reside en la palabra «extensas». Cuando cortamos con Cas en un sitio muy concreto del genoma, la célula inmediatamente repara el corte. Las células de eucariotas tienen varios mecanismos de reparación, bastante fiables… pero no al 100%. Es decir, cometen errores cuando reparan un corte en una cadena de ADN. Por lo tanto, si el corte que yo hago es extenso puede que el mecanismo de reparación cometa errores al arreglarlo… con lo que no hemos avanzado mucho. Sin embargo, la tecnología CRISPR está avanzando a toda velocidad para solucionar un montón de problemas técnicos. Aquí puedes leer un post que escribió hace muy poquito nuestro compañero Álvaro en donde puedes leer cómo se ha conseguido ya solucionar ese problema… en parte. https://www.dciencia.es/la-nueva-revolucion-en-la-edicion-genica-el-prime-editing-un-paso-mas-alla-de-crispr/ Sobre utilizar CRISPR en cultivos celulares, sí, es posible (y legal), pero aún tenemos limitaciones, sobre todo si es para mutaciones extensas como tú dices. En embriones… pues ya sabes que por temas éticos y legales el uso de CRISPR en ellos está frenado hasta que se aclaren las cosas.
Saludos
¿Es posible modificar nuestro ADN para mejorar nuestras habilidades por ejemplo con los chimpancés que tienen unos músculos en 5 y 7 veces más eficientes que los nuestros? Un saludo, gracias por el artículo.
Técnicamente sí sería posible, siempre y cuando se conocieran los genes concretos implicados en ese aumento de la eficiencia (y no fueran demasiados). Ética y legalmente no
¿Es posible modificar nuestro ADN para mejorar nuestras habilidades como por ejemplo con los chimpancés que tienen unos músculos entre 5 y 7 veces más eficientes que los nuestros? Gracias por el artículo, de mucha ayuda. Saludos
Cómo se cambia la genética de todo un ser vivo o de todo un órgano o sistema del mismo modificando sólo algunas de sus células?
No, si modificas solo una célula, cambias el genoma de esa células. Para cambiar el genoma de todo el organismo hay que hacerlo antes, en las células embrionarias
[…] que per millorar genèticament el meló es podrien incorporar tècniques d’edició genòmica com CRISPRCas9. Aquesta tecnologia ja s’està utilitzant al laboratori de Garcia‐Mas i permet “editar” el […]
Solo quiero agradeceros la fabulosa labor que realizáis. Personas como vosotros hacéis que este mundo avance y se desarrolle en la dirección correcta. Sois el valor humano imprescindible capaces de obrar milagros con vuestro trabajo diario y con el poco reconocimiento que solo después del éxito se os otorga. Gracias