Los elementos en los humanos (O, C, H, N, Ca, P)
Dentro de la serie que estamos haciendo en Dciencia sobre los elementos químicos de la tabla periódica, hoy vamos a hablaros de los elementos que están presentes y forman parte del cuerpo humano.
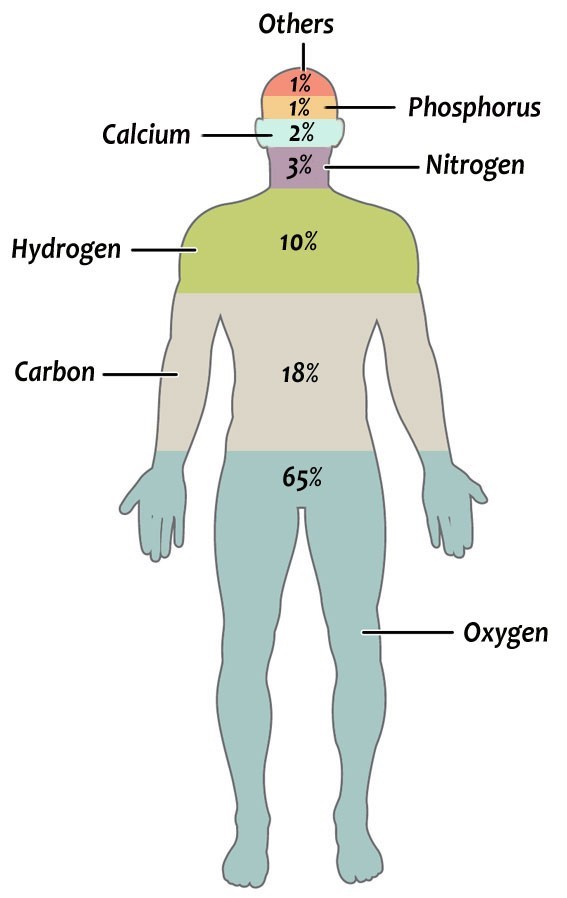
Y es que, aunque no podamos imaginárnoslo, el cuerpo humano no es más (ni menos) que un conjunto de elementos químicos en diferentes proporciones. Casi el 99% de la masa del cuerpo humano está formada por seis elementos: oxígeno (65%), carbono (18%), hidrógeno (10%), nitrógeno (3%), calcio (2%) y fósforo (1%). El pequeño porcentaje restante (~1%) está formado por una larga lista de otros elementos, de los cuales podemos destacar el potasio, el azufre, el sodio, el cloro, el magnesio, el yodo, el hierro y el zinc. Todos estos elementos son necesarios para la vida.
OXÍGENO
Su símbolo químico es O y su número atómico es el 8. El oxígeno es el elemento más abundante en el cuerpo humano, y como nos explicó nuestro compañero el Dr. Alberto Morán en el capítulo anterior, Los elementos que respiramos, el oxígeno lo respiramos y nos permite obtener energía para que así cada célula del cuerpo pueda realizar sus funciones. Sin oxígeno, las células de nuestro cuerpo se mueren. Alberto también nos habló de la historia, propiedades, métodos de obtención y aplicaciones del oxígeno.
El oxígeno y la vida humana:
El oxígeno es estrictamente necesario para nuestra vida. Forma parte del agua (H2O) y de todo tipo de moléculas orgánicas. Además, como hemos comentado, lo necesitamos para producir energía en nuestras células. ¿Y cómo se produce esta energía en nuestras células? La energía se produce en lo que conocemos como “respiración celular” (no confundir con “respiración pulmonar”), un proceso por el cual nuestras células degradan las moléculas de los alimentos (principalmente la glucosa) para obtener energía en forma de ATP (adenosina trifosfato), la denominada “moneda energética” del organismo. Es un proceso complejo, con diferentes etapas encadenadas. La última etapa, llamada fosforilación oxidativa, se produce en las mitocondrias de las células, y es cuando el oxígeno tiene un papel esencial. El oxígeno recibe los electrones procedentes de la cadena de transporte de electrones y recolecta protones del medio para formar agua. En este proceso se libera gran cantidad de ATP.
CARBONO
Su símbolo químico es C y su número atómico es 6. Pertenece al Grupo 14 de la tabla periódica (familia del carbono o los carbonoideos), y se distribuye ampliamente en la naturaleza. Es el pilar básico de la química orgánica y forma parte de todos los seres vivos. Es un elemento único en cuanto a la gran cantidad de compuestos distintos que puede formar. En la naturaleza puede encontrarse en distintas variedades alotrópicas (alotropía es la propiedad de algunas sustancias simples de poseer estructuras atómicas o moleculares diferentes). Las variedades más conocidas del carbono son el grafito y el diamante, pero también están el grafeno, los nanotubos de carbono y el fullereno. Por último, se encuentra la forma amorfa del carbono, conocido como negro de humo, que es un pigmento de carbono que se obtiene mediante la combustión incompleta de diferentes materiales.
Historia:
Los nombres de las diversas formas del carbono proceden del latín y del griego. “Carbón” viene del latín “carbo”; “grafito” del griego “graphein” (escribir) y “diamante” del latín “adamas” (indomable e invencible), que fue evolucionando a adamant > diamaunt > diamant y, por último, diamante.
El carbón como hollín y carbón vegetal ya se utilizaba en la prehistoria. El grafito y el diamante eran conocidos por las civilizaciones antiguas.
El descubrimiento de los fullerenos es mucho más reciente, fue en 1985 cuando los químicos Harold Kroto, Robert Curl y Richard Smalley descubrieron estas moléculas de carbono que puede adoptar formas geométrica que recuerdan a una esfera, una elipse, un tubo o un anillo. Este descubrimiento los llevó a ser galardonados con el Premio Nobel de Química en 1996.
Propiedades:
A temperatura ambiente se encuentra en estado sólido. Sorprendentemente, el grafito es uno de los materiales más blandos conocidos, mientras que el diamante es uno de los más duros. Existen tres isótopos de carbono que se producen de forma natural, el 12C y 13C (estables) y el isótopo radiactivo 14C.
El carbono y la vida humana:
El carbono es el segundo elemento más abundante en nuestro cuerpo. Concretamente supone el 18% de la composición de nuestro organismo (es decir, unos 13 kilos en un adulto de unos 70 kilogramos de peso). Sin embargo, el carbono en nuestro organismo nunca se encuentra como elemento químico individual, sino que siempre está formando compuestos junto con otros elementos. El papel principal del carbono en relación con la vida deriva de su capacidad para formar cuatro enlaces que permiten construir cadenas de moléculas largas y complejas. El enlace entre moléculas de carbono es esencial para nuestra vida. Es un enlace que se puede romper aportando muy poca energía, lo cual permite que se rompan fácilmente unos compuestos carbonados y se formen otros nuevos. Esto hace que el organismo pueda fabricar con poco gasto energético las moléculas que necesita a partir de otras que ya no necesita o de aquellas que se han absorbido por la dieta. De hecho, el carbono es parte esencial de todas las macromoléculas, proteínas, grasas y glúcidos, también llamados estos últimos hidratos de carbono. Es, por tanto, un elemento que forma parte de todas las estructuras de nuestro cuerpo. Además, de las moléculas que contienen carbón, como la glucosa, nuestras células obtienen energía en el proceso que hemos descrito anteriormente, con el oxígeno.
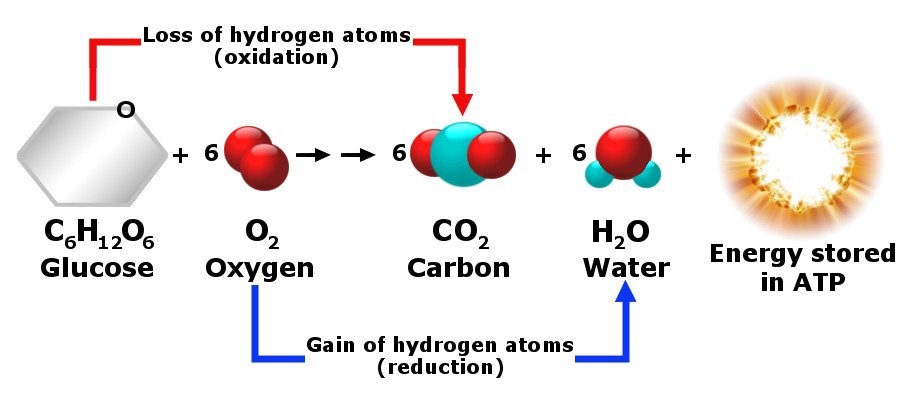
Por otra parte, también hay que tener en cuenta la importancia del dióxido de carbono (CO2) en nuestro organismo. Es un producto de desecho procedente de diversas reacciones celulares.
También mencionar que hay algunos compuestos de carbono, como el monóxido de carbono y el cianuro, que son extremadamente tóxicos para los mamíferos. A todos os sonará el caso de los mineros, que, debido a la inhalación de grandes cantidades de carbono durante periodos prolongados, puede desarrollar la enfermedad del pulmón negro.
La huella de carbono:
No quería terminar con este elemento sin hablar de la huella de carbono (en inglés, carbon footprint), que hace referencia a la totalidad de gases de efecto invernadero (medidos como CO2 equivalente) emitidos por efecto directo o indirecto a través de la actividad que desarrolla un ciudadano, una organización, la fabricación de un producto o la prestación de un servicio. En este momento de gran crisis climática que estamos viviendo, todos tenemos que hacer un gran esfuerzo por reducir nuestra huella de carbono.
HIDRÓGENO
Su símbolo químico es H y su número atómico es el 1. Es el elemento químico más “ligero” de la tabla periódica y el más abundante en el universo (el 76% del universo está formado por hidrógeno). En el primer artículo de esta serie, el Dr. Fernando Herranz ya nos habló del hidrógeno como el elemento más abundante en las estrellas. Os dejo aquí el link por si os apetece ir a él: https://www.dciencia.es/elementos-en-las-estrellas/.
El hidrógeno y la vida humana:
Solo comentaros que el hidrógeno es el tercer elemento en cantidad en nuestro cuerpo, fundamentalmente porque está presente en el agua (H2O), y hay que recordar que el agua supone más del 60% del peso de nuestro cuerpo. Además, casi todos los compuestos carbonados portan en su composición también hidrógeno.
NITRÓGENO
Su símbolo químico es N y su número atómico es el 7.
El nitrógeno es el principal componente de la atmósfera (78%), y el elemento más abundante que respiramos. Ya os hablamos de él en Los elementos que respiramos.
El nitrógeno y la vida humana:
El nitrógeno forma parte de muchas biomoléculas, pero destaca su presencia en los ácidos nucleicos y los aminoácidos. El nitrógeno forma parte estructural de las 5 bases nitrogenadas (adenina, guanina, citosina, timina y uracilo) que forman parte de los ácidos nucleicos, el ADN y el ARN. En la estructura de doble hélice del ADN, la adenina forma pareja con la timina (A=T), mientras que la citosina es la pareja de la guanina (CºG). La complementariedad entre las bases nitrogenadas es la esencia de la estructura del ADN, y la disposición secuencial de estas 4 letras a es lo que determina la información genética. Fragmentos concretos del ADN (denominados genes) son copiados a ARN, proceso que se conoce como transcripción. A continuación, este ARN se utiliza para generar las proteínas en los ribosomas. Las proteínas son cadenas de aminoácidos. En el código genético está la información de 20 aminoácidos distintos, cuyas infinitas combinaciones dan lugar a las proteínas que son los verdaderos actores de nuestras células. Las que se encargan de trabajar, cada una en una tarea distinta, para que todo funcione correctamente.
Además, el nitrógeno también forma parte de otras moléculas como son los lípidos (las grasas) o el óxido de nitrógeno (NO). El NO es muy importante en nuestro organismo ya que participa en la relajación de los músculos, en el sistema cardiovascular, el sistema inmunitario, el sistema nervioso central y el sistema nervioso periférico.
CALCIO
Su símbolo químico es Ca y su número atómico es el 20. El calcio es el quinto elemento más abundante en la corteza terrestre. Los compuestos de calcio constituyen un 3.64% de la corteza terrestre.
Historia:
Los carbonatos de calcio (la calcita y la dolomita) se conocen desde la antigüedad. El calcio fue preparado por primera vez por el químico británico Humphry Davy en 1808 en Londres. Davy obtuvo el calcio mezclando cal humedecida con óxido de mercurio, y mediante electrólisis obtuvo una amalgama que resultó ser calcio puro.

Calcita blanca
Propiedades:
El calcio es un metal alcalinotérreo, blanco plateado, maleable y dúctil, que arde con una llama amarilla-roja. Reacciona violentamente con el agua en su estado de metal para formar hidróxido de calcio desprendiendo hidrógeno.
El calcio y la vida humana:
De los minerales que componen el organismo, el calcio es el más abundante y es esencial para la vida. Tiene una función estructural ya que se encuentra en los huesos y en los dientes. También participa en la transmisión de los impulsos nerviosos, en la regulación de los latidos cardiacos y en la coagulación de la sangre. Está implicado en la regulación de algunas enzimas, como por ejemplo la proteína quinasa C (PKC).
FÓSFORO
El símbolo químico del fósforo es P y su número atómico es el 15. El fósforo no se encuentra como elemento nativo, pero es el elemento principal de los fosfatos, que son unos compuestos importantes tanto en la naturaleza como en nuestro propio cuerpo. De hecho, es el undécimo elemento más abundante en la Tierra.
Historia:
Este elemento químico fue descubierto por el alquimista alemán en 1669 en el transcurso de sus experimentos encaminados a la búsqueda de la piedra filosofal. Así, al mezclar orina y arena y destilar la mezcla, cuando se evaporaba la urea, obtenía un material blanco que brillaba en la oscuridad. Su nombre proviene de la unión de dos palabras griegas fos, que significa “luz” y foros, que significa “portador”.
Propiedades:
El fósforo existe en tres formas, blanca, roja y negra. El fósforo blanco es muy tóxico e inflamable. Cuando se calienta a 300-400 ºC en ausencia de oxígeno, se transforma en fósforo rojo, que no es tóxico. Si el fósforo blanco o el rojo se calientan a 200 ºC a una presión de 12.000 bar, se obtiene el fósforo negro.
El fósforo y la vida humana:
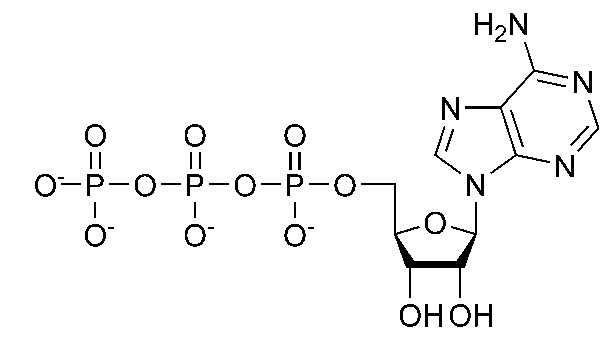
El fósforo es un elemento esencial para la vida. El ser humano contiene, aproximadamente, 770 gramos de fósforo en su organismo. El fósforo tiene dos funciones principales en el cuerpo humano. Por un lado, es muy importante para las estructuras óseas del cuerpo, donde se encuentra el 90% de todo el que tenemos en nuestro cuerpo. Pero por otro cumple un fundamental papel energético, puesto que forma parte de la molécula de ATP. Recordemos que se trata de la “moneda energética” de la célula. Es decir, es la molécula que acumula la energía que es usada para llevar a cabo todas las funciones celulares. En su fórmula podéis ver que lleva tres átomos de fósforo (en forma de grupos fosfato).
About the Author: María Arechederra
24 Comments
Leave A Comment Cancelar la respuesta
Este sitio usa Akismet para reducir el spam. Aprende cómo se procesan los datos de tus comentarios.








Muchas gracias por la información, realmente interesante el artículo.
gracias ppor la informacion
Dra. buenos días le hablamos desde Bolivia, quisiera saber si puedo utilizar y usar parte de su artículo para respaldar un otro artículo
que mi hijo está escribiendo para su colegio? le agradecería mucho su autorización para este fin.
Por supuesto que puede usarlo, sin problemas. Gracias y un saludo
buenos días me comparte por favor la fecha en que sacaron este articulo
Sí, claro, 12 de diciembre de 2019. Lo pone al final del artículo. Saludos
Muchas gracias es un articulo completo e interesante, me tome el atrevimiento de copiar el texto donde aparecen las características para mis alumnos de secundaria, claro con su respectivo crédito al escribir también la dirección electrónica, saludos, Gracias por compartir esta información.
Gracias, sin problema, muchas gracias por citarnos
Dc. Alberto, me sirvió bastante para mi tarea de Química, no se que hubiera hecho sin su información, ya que no todas las paginas explican tan bien, de verdad muchas gracias, cuidarnos todos, suerte.
Claro que se lo compartiré a mis amigos. 🙂
hola
ola
MUCHAS GRACIAS POR SU VALIOSA APORTACIÓN, CLARA, ESPECIFICA, ÚTIL, GRACIAS!!!!!
mucha gracias
me ayudo mucho para la tarea
muchas gracias
me ayudo mucho para la tarea
Muchas Gracias por la informacion me fue de gran utilidad
Gracias a ti por leerlo!
[…] cuerpo es un conjunto de elementos químicos y el 65% de esos elementos es el OXÌGENO esto quiere decir qué, si puedes actuar de forma […]
[…] cuerpo es un conjunto de elementos químicos y el 65% de esos elementos es el OXÌGENO, esto quiere decir qué, si puedes actuar de forma […]
[…] esto presente, va a ser un increíble tema de capacitación de elementos humanos para educar a sus equipos sobre de qué manera utilizar las resoluciones y, en el momento en que […]
buenos dias me gusta mucho este articulo y me sirve para una tarea de colegio , me podrian ayudar con su cuidad de origen para mi cita , por favor.
Alberto, no pone la fecha!!!
12 de diciembre de 2019
Buenas tardes mi estimado, le escribo desde México para darle las gracias ya que su artículo me sirvió para completar mi tarea de Química.