La nueva vida de la talidomida
La talidomida, tristemente conocida por el caso del síndrome tóxico en las embarazadas, está teniendo un nuevo resurgir como fármaco. Esta vez está siendo usada, con gran efectividad, para el tratamiento de un tipo de cáncer conocido como mieloma múltiple. En este artículo vamos a repasar cómo la identificación de nuevos usos de fármacos, también conocido como reposicionamiento de fármacos, da una nueva oportunidad a enfermos sin tener que desembolsar grandes sumas de dinero en ensayos clínicos y de manera mucho más rápida.
Mieloma múltiple, ¿qué es?
El mieloma múltiple es, básicamente, un cáncer que afecta a las células plasmáticas. Pero claro, tras esta definición surge de inmediato la siguiente pregunta ¿Qué son las células plásmaticas? Las células plasmáticas son un tipo celular encargado de producir anticuerpos, nuestras mejores defensas contra las infecciones. Normalmente se encuentran en la médula ósea y son un componente importante del sistema inmunitario. Como sabéis, el sistema inmunitario se compone de varios tipos de células que funcionan juntas para combatir las infecciones y otras enfermedades. Entre estos tipos celulares se encuentran los linfocitos (también conocidos como células linfáticas), los granulocitos, los macrófagos, las células dendríticas y las células plásmaticas. Los linfocitos son uno de los tipos principales de glóbulos blancos del sistema inmunitario y se subdividen a su vez en las células T y células B. Los linfocitos están en muchas áreas del cuerpo, tal como en los ganglios linfáticos, la médula ósea, los intestinos y el torrente sanguíneo, patrullando para combatir los patógenos (virus y/o bacterias generalmente). Cuando las células B se encuentran con un virus o una bacteria responden a una infección, maduran y se transforman en auténticas factorías de anticuerpos contra esa infección. Cuando la infección desaparece, el cuerpo, conserva algunas de esas factorías (como hemos dicho, células B maduras) almacenándolas en la medula ósea, para tener una respuesta más rápida en el caso de futuras infecciones. Esta es la base, por ejemplo, de las vacunas. A esas fábricas de anticuerpos (o células B maduras) almacenadas se les llama células plasmáticas.
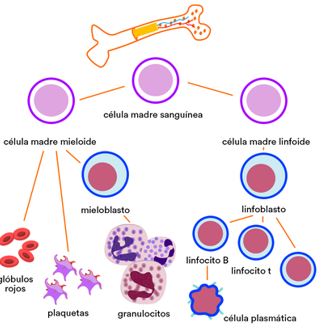
Esquema que muestra los diferentes tipos celulares. Obsérvese como las células plasmáticas son una variedad diferenciada (o “madura”) y productora de anticuerpos provenientes de los linfocitos B. Imagen obtenida de la pagina web de la Fundación Josep Carreras.
Además de las células plasmáticas, la médula ósea normal es también el hogar de otras células sanguíneas, como los glóbulos rojos, otros glóbulos blancos y las plaquetas, tipos celulares imprescindibles para la vida. El mieloma múltiple se produce cuando las células plasmáticas se vuelven cancerosas y crecen fuera de control. Estas células tumorales desplazan al resto de células de la medula ósea llegando a producir anemias o inmunodeficiencias. Diréis ¿Por qué? Pues porque las células plasmáticas tumorales crecen tanto, que literalmente ocupan todo el espacio y no dejan sitio para que “nazcan”, entre otros, más glóbulos rojos, y eso es grave. Además, surge otro problema; las células plasmáticas se especializan en producir anticuerpos contra un tipo concreto de patógeno. Pensad que tenemos células plasmáticas para todas aquellas enfermedades de las que nos hemos vacunado o que hemos pasado, y estas células plasmáticas producen anticuerpos diferentes contra todos esos patógenos. Es decir, cada uno de nosotros tenemos en nuestra sangre anticuerpos contra todas las enfermedades que hemos padecido lo cual nos mantiene protegidos. Sin embargo, el cáncer se produce solo en una de esas células plasmáticas, así que, esta producirá un exceso de ese anticuerpo para el que se habían especializado, pero solo uno. Pensad, además que el resto de células plasmáticas están siendo reducido o eliminando porque no les dejan sitio para establecerse, y por tanto, cae la producción de otros anticuerpos. Este efecto se conoce por varios nombres diferentes, entre los que se incluyen inmunoglobulina monoclonal, proteína monoclonal (proteína M), pico M o paraproteína, y es una característica de la enfermedad.

Las células tumorales se vuelven mayoritarias reduciendo otras poblaciones celulares encargadas de producir linfocitos o glóbulos rojos, generando anemias. Además, se produce un incremento anormal de un tipo de anticuerpos generándose inmunodeficiencias.
REPOSICIONAMIENTO DE LA TALIDOMIDA PARA EL TRATAMIENTO DEL MIELOMA MÚLTIPLE
Existen varios tratamientos para este tipo de cáncer incluyendo el transplante de médula ósea, la dexametasona o el bortezomib. Sin embargo, hay muy pocas opciones para los pacientes que no responden a estos tratamientos. En 2006, la FDA (la agencia del medicamento americana) aprueba el uso de la lenalidomida (una versión menos tóxica de la talidomida) para el tratamiento del mieloma multiple en combinación con la dexametasona, para pacientes que habían recibido un tratamiento anterior. Este era un medicamento que ya se conocía desde la década de los 50-60. Aunque inicialmente (y desafortunadamente) se usó para evitar las nauseas en embarazadas, sin saber que producía malformaciones en los fetos. Sin embargo, no es hasta el 2014 cuando se descubre el fascinante mecanismo biológico que explica su función en dos fantásticos trabajos publicados en Science 1 y 2, catapultando su uso y sirviendo como base para el desarrollo de otros tratamientos. En 2015 se aprueba el uso de lenalidomida más dexametasona en pacientes recién diagnosticados, y en 2017 se aprueba su uso para todos los pacientes, incluso como terapia de mantenimiento y prevención en pacientes que han recibido transplantes de médula ósea. La talidomida, así como sus derivados, son capaces de reducir el número de células tumorales. Este efecto es, por supuesto, muy bien recibido por la comunidad científica, dada la escasez de opciones disponibles para el tratamiento del mieloma múltiple. Aún más interesante es su modo de acción, un maravilloso mecanismo que utiliza la propia maquinaria de degradación de proteínas de la célula. Pero vayamos paso a paso.
Las células de mieloma son adictas a dos proteínas de nombre mitológico, aiolos e ikaros. Estas dos proteínas son factores de transcripción, es decir, auténticos ingenieros responsables de reprogramar a las células e incluso de transformar a la célula normal en tumoral. ¿Qué significan que sean adictas? Pues que sin esas proteínas las células tumorales no pueden sobrevivir. Es decir, nos están mostrando su fortaleza, pero también su talón de Aquiles. El objetivo es claro, si conseguimos eliminar esas dos proteínas, podríamos matar a las células cancerosas. Parece fácil, pero claro, la célula cancerosa también va a hacer todo lo posible por evitar que le eliminen esas dos proteínas. Milagrosamente, la talidomida, reduce los niveles de esas 2 proteínas, suponiendo un tratamiento efectivo para esta enfermedad, ¡y enseñándonos un mecanismo que puede servir para otros muchos tumores!
Para entender como la talidomida reduce los niveles de esta enfermedad tenemos que introducir un nuevo actor: la trituradora de basura que contiene la célula, también conocido como proteosoma. Esta trituradora de basura es un mecanismo que sirve para reciclar las proteínas viejas o defectuosas. Las células, al igual que nosotros, también reciclan las proteínas, las rompen en moléculas pequeñas que luego usan de nuevo para formar otras proteínas. Esta trituradora de basura está muy controlada, porque claro, si rompemos proteínas importantes, la célula morirá. Y ahí está la clave, la talidomida engaña a este sistema para obligarle a que triture a esas dos proteínas importantes para la célula. La trituradora de basura funciona de una forma muy curiosa, se encarga de degradar todas las proteínas que están marcadas con una “bandera” llamada ubiquitina. Este proteosoma, no es muy selectivo que se diga, todo aquello que tenga varias de esas banderas, se degrada. Por lo tanto, el proteosoma no nos da muchas opciones y tenemos poco que hacer, sin embargo, sí podemos “engañar” a la maquinaria encargada de colocar esa bandera o ubiquitina.
La ubiquitina es una proteína pequeña que fue descubierta en 1975 y, como su nombre indica, es ubicua en las células eucariotas. El sistema de ubiquitinación de proteínas fue descrito por el grupo del Dr. Ciechanover, logro que fue merecedor del premio Nobel de Química en el año 2004. Este grupo caracterizó la función de la ubiquitina como una marca para la subsecuente degradación de las proteínas en esa trituradora de basuras. ¿Cómo funciona? La ubiquitina se carga y se activa gracias a un complejo de enzimas llamadas E1 y E2. Una vez activa, este complejo de enzimas necesita un tercer componente la E3. Este E3 es quien decide donde hay que pegar la ubiquitina. Funciona como una llave que solo es capaz de reconocer una región (sería la “cerradura” aunque la palabra científica es “degron”) presente en una o varias proteínas. Acordaros que aquella molécula que lleve ubiquitina va a ser degradada, ahí no hay vuelta atrás, así que este sistema no puede ir añadiendo alegremente ubiquitina. Hay cientos de E3 que identifican cada uno diferentes proteínas según ese esquema llave-cerradura, de manera que una célula puede regular esas proteínas E3 para regular los niveles de proteínas.

Esquema de funcionamiento de la degradación de proteínas vía proteosoma. Genetics of Proteasome Diseases
¿Qué hacen las células de mieloma? Aumentan los niveles de expresión y eliminan aquellos mecanismos que pueden reducir a esas dos proteínas tan importantes para ella, ikaros y aiolos.
¿Qué es lo que ocurre cuando tratamos a estos tumores con la talidomida (o sus análogos)? Pues, sorprendentemente, la talidomida se une a una E3 (llamada Cereblon CRBN) y modifica esa llave de tal forma que, ahora sí reconoce a ikaros y aiolos. Como si fuese una ganzúa que ahora puede abrir una nueva cerradura. Sorprendente ¿verdad?, y claro, la E3 modificada hace lo que sabe hacer, que es pegarle una molécula de ubiquitina a ikaros y aiolos, y otra, y otra… y con todas esas señales, la trituradora de basura hace lo que sabe hacer, degradarlas, y sin estas proteínas, la célula de mieloma múltiple se muere.

La talidomida (o sus análogos agrupados como IMiD) modifica la superficie del complejo E3 (CRBN) actuando como un pegamento y permitiendo que la proteína ikaros (IKZF1) sea degradada.
Este efecto, estos hallazgos abren la puerta a toda una nueva línea de tratamientos, puesto que podemos modificar las E3 (las llaves) para degradar la(s) proteína(s) que queramos, ¡y todo lo hace la propia célula a través de su sistema de reciclaje! Gracias a este efecto, se han podido obtener varios fármacos antitumorales como los PROTACS que actualmente se usan para tratar el cáncer de mama.
Por supuesto, las células tumorales contraatacan, desarrollando sistemas para mantener escondidas a las cerraduras y evitar ser ubiquitinadas por las E3. Imaginaos… ¡una auténtica carrera evolutiva para poder sobrevivir!, aunque eso, lo veremos en otro post.
REFERENCIAS:
- 2014 Jan 17;343(6168):301-5. doi: 10.1126/science.1244851. DOI: 10.1126/science.1244917
- 2014 Jan 17;343(6168):305-9. doi: 10.1126/science.1244917. DOI: 10.1126/science.1244917
- Scientifica, vol. 2013, Article ID 637629, 30 pages, 013. DOI: 10.1126/science.1244851
- Web: Fundación Josep carreras (https://www.fcarreras.org/es)
- Web: dreamstime.com/multiple-myeloma-plasma-cell-cancer
- Web: cancer.gov/FDA-lenalidomida-mieloma-mantenimiento
About the Author: Alvaro Gutierrez-Uzquiza
One Comment
Leave A Comment Cancelar la respuesta
Este sitio usa Akismet para reducir el spam. Aprende cómo se procesan los datos de tus comentarios.







[…] no muchas semanas publicamos en Dciencia un post en el que os hablábamos de como la tristemente famosa talidomida se está ahora empleando para el […]