2019, el año de la tabla periódica
Como ya sabréis, el 20 de diciembre de 2017 la Asamblea General de la ONU declaró el año 2019 como el Año Internacional de la Tabla Periódica de los elementos Químicos, para conmemorar el 150 aniversario de su enunciado por parte del químico Dmitri Mendeleev. En Dciencia vamos a cerrar este año conmemorativo con una serie de artículos dedicados a la tabla periódica y los distintos elementos químicos. En este primer artículo daremos una visión general sobre la tabla periódica y repasaremos brevemente su importancia y su desarrollo histórico.

Figura 1. Tabla periódica de los elementos químicos
La tabla periódica es una organización tabular de los elementos químicos en orden creciente de su número atómico, ordenado en filas (períodos) y columnas (grupos) para resaltar sus propiedades recurrentes (Figura 1). Esta ley periódica establece que las propiedades químicas y físicas de los elementos son semejantes de forma periódica si estos se ordenan en orden creciente de su número atómico (de su número de protones en el núcleo). Actualmente se reconocen 118 elementos agrupados en 18 grupos. La tabla periódica es una herramienta de uso diario en química e ingeniería química, pero, también, en arqueología, astronomía, biología, física, geología y diferentes ingenierías.
Un primer aspecto que hay que dejar claro es que el desarrollo de la tabla periódica, como cualquier desarrollo en ciencia, no fue el resultado de la inspiración de un científico en particular, Dmitri Mendeleev en este caso, como parece en el imaginario popular. Los principales avances hacia un sistema organizado de clasificación de los elementos químicos se produjeron durante la década 1862-1872 con los trabajos de Chancourtois, Newlands, Odling, Meyer y el propio Mendeleev, entre otros. Dicho esfuerzo común tuvo como fruto la publicación de la primera versión moderna de la tabla periódica en 1869, ordenada por orden creciente de los pesos atómicos. Este hecho, el uso de los pesos atómicos, fue una de las principales dificultades que tuvo que atravesar la primera versión de la tabla. Por ejemplo, el orden lógico (según sus propiedades químicas) de varias parejas no se correspondía con el de sus pesos atómicos: argón-potasio, cobalto-níquel y telurio-yodo. Este tipo de discrepancias se resolvió, años después, con los sucesivos descubrimientos de la estructura de los átomos y el uso del número atómico para establecer el orden de los elementos. A pesar de los problemas debidos a la discrepancia de ciertos pesos atómicos, la tabla periódica moderna, gracias a la valentía de Mendeleev, tuvo éxitos resonantes que confirmaron su validez.
Quizás el mayor de estos éxitos fue la capacidad de predecir el descubrimiento de nuevos elementos. Cuando Mendeleev encontraba que un elemento no encajaba en la posición que le correspondía suponía que el peso atómico había sido determinado de forma errónea, indicándolo con un interrogante en su símbolo. En otras ocasiones dejó huecos en la tabla al no encontrar un elemento que se ajustara a esa posición, prediciendo además el peso atómico que debería tener y describiendo las propiedades químicas que ese elemento —no descubierto todavía— presentaría. Así procedió en la versión de la tabla periódica de 1871, con la predicción de cuatro elementos químicos por descubrir: el eka-boro, el eka-aluminio, el eka-silicio y el eka-manganeso. El prefijo eka- (del sánscrito) significa ‘uno’ y designaba la posición del elemento «incógnita» respecto del elemento ya conocido. El primer gran éxito tuvo lugar en 1875 cuando el químico francés Paul Émile Lecoq anunció el descubrimiento de un nuevo elemento, hallado en el mineral de esfalerita (sulfuro de zinc), al que llamo galio en honor de Francia (Gallia en latín) … o de sí mismo según las malas lenguas (Lecoq, el gallo, de gallus en latín). El galio era el elemento eka-aluminio predicho por Mendeleev. Este hecho era en sí mismo un éxito de la tabla periódica, pero la cosa no quedó ahí. Según las mediciones de Lecoq el galio tenía una densidad de 4.7 g/cm3, valor que discrepaba del predicho por Mendeleev para el eka-alumnio (5.9 g/cm3). En un alarde de confianza el químico ruso publicó una carta en la Academia de Ciencias de París asegurando que las medidas eran erróneas y que la densidad debía estar entre 5.9 y 6.0 g/cm3, sugiriendo a Lecoq que repitiera el análisis con una muestra más pura. El químico francés repitió dicho ensayo, encontrando que el valor de la densidad del galio (eka-aluminio) era exactamente de 5.9 g/cm3. Esta espectacular confirmación de la ley periódica de Mendeleev fue corroborada en los años siguientes con el descubrimiento del escandio (eka-boro) y del germanio (eka-silicio).
Mendeleev continuaría refinando y actualizando la versión de la tabla periódica hasta su muerte, con nuevas versiones en 1889 y 1903. Lógicamente los avances no acabaron ahí y en los años siguientes la tabla periódica fue una fuerza impulsora de nuevos descubrimientos como la radioactividad y la mecánica cuántica que, a su vez, ayudaron a hacer aún más sólida la ley periódica de Mendeleev.
Otro aspecto poco conocido es que la representación más aceptada de la tabla periódica (Figura 1) no es, ni mucho menos, la única. Algunas fuentes citan hasta 700 tipos distintos de tablas que se pueden dividir en tablas 2D o 3D, tablas cortas o largas y tablas químicas o de configuración electrónica. En muchos casos estas tablas alternativas respondían a un intento de mejorar la representación actual, con los elementos lantánidos y actínidos fuera del bloque principal de la tabla, en otros casos respondían a criterios estéticos de dudosa utilidad. Algunas de las formas alternativas de representar la tabla periódica se recogen en la Figura 2. Por ejemplo, en la actualidad la IUPAC (International Union of Pure and Applied Chemistry) estudia cambiar la actual distribución de la tabla periódica, incluyendo a los lantánidos y actínidos en la tabla principal, una tabla de 32 grupos. La principal razón es que la forma tradicional de representar la tabla (Figura 1), con los lantánidos y actínidos fuera de su sitio, no se debe a razones químicas si no de facilidad de representación e impresión, dificultades que en la actualidad están superadas. Las distintas formas de representar la tabla resaltan un hecho a veces olvidado, no existe «La» tabla periódica. La ley periódica de los elementos se puede representar de muchas formas igualmente válidas.
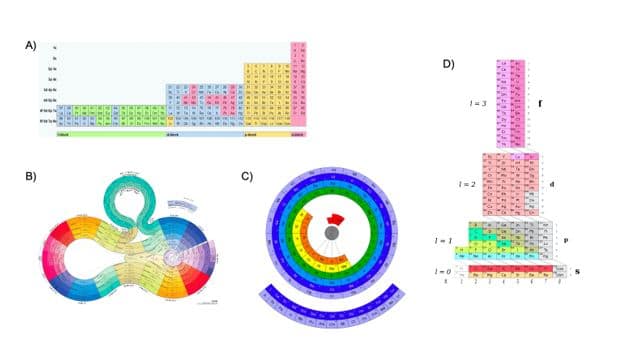
Figura 2. A). Tabla periódica de Charles Janet; B). Tabla periódica de cinta curvada. Rezmason – CC BY-SA 4.0; C) Tabla en espiral. C. Buckley, CC BY 3.0, y D) Tabla ADOMAH. De Piep – CC BY-SA 3.0.
En palabras del químico inglés John Emsley «Cualquier civilización inteligente de otra galaxia tiene una tabla periódica muy parecida a la nuestra: es un icono universal en el sentido más amplio». La tabla periódica es una herramienta de uso diario, pero, además, se ha convertido en un icono cultural, en una de las imágenes más populares de la ciencia en general. La tabla periódica es casi un meme, utilizado para la clasificación “periódica” de casi todo, desde cerveza, a emociones y ¡posturas sexuales! Nos podemos encontrar referencias más o menos directas a la tabla periódica en todo tipo de obras culturales, desde series de televisión (Figura 3) a obras de teatro, películas (Evolución, Arsénico por compasión, Gilda, Lobos sucios, etc) y, por supuesto, obras literarias.

Figura 3. Breaking bad y la tabla periódica.
Hay muchos libros que permiten acercarse de forma amena y rigurosa a la tabla periódica: El sistema periódico de Primo Levi, El tío Tungsteno: recuerdos de un químico precoz de Oliver Sacks, El año del wólfram de Raúl Guerra y El secreto de Prometeo de Alejandro Navarro.
En Dciencia queremos contribuir a esta divulgación amena y rigurosa de la tabla periódica y los elementos químicos. A lo largo de las próximas semanas desde Dciencia rendiremos nuestro particular homenaje a la tabla periódica de los elementos químicos con cinco artículos que se centrarán en distintos elementos y que hemos agrupado en los siguientes temas:
-Elementos en las estrellas.
-Elementos que respiramos.
-Elementos en los humanos.
-Elementos para el asesinato.
-Elementos para la medicina.
-Elementos para la tecnología.
Referencias.
Nature’s Building Blocks. John Emsley
La tabla periódica de los elementos químicos. J. Elguero, P.Goya, P.Román
The Elements of Murder. John Emsley
Encyclopedia of the Elements. P. Enghag
El tío Tungsteno: recuerdos de un químico precoz, Oliver Sacks
El año del wólfram, Raúl Guerra
El secreto de Prometeo de Alejandro Navarro.







