Descubierta la capacidad promotora de la metástasis en el cáncer de próstata de la proteína HGK
Las metástasis de cáncer de próstata tienen tendencia a localizarse en los huesos. Una vez que los pacientes de cáncer de próstata desarrollan metástasis ósea, el pronóstico es muy malo. Por lo tanto, es muy importante identificar las moléculas que son esenciales en este proceso de metástasis, para desarrollar nuevas estrategias terapéuticas que eviten un desenlace fatal.
En este trabajo hemos identificado a la proteína HGK como una molécula importante en el proceso de metástasis del cáncer de próstata. Voy a intentar explicaros de manera sencilla qué hemos encontrado exactamente, cómo lo hemos hecho y por qué es importante.
El cáncer de próstata
Según la Organización Mundial de la Salud, OMS, el cáncer de próstata es el segundo cáncer más frecuente entre los hombres y la quinta causa de todas las muertes. Una de las buenas noticias es que la mayoría de los pacientes de cáncer de próstata tienen tumores que responden a los tratamientos, y afortunadamente presentan una muy buena tasa de supervivencia. Sin embargo, esta situación empeora de manera clara en algunas situaciones generalmente asociadas o coincidentes con procesos metastásicos. El cáncer de próstata presenta una evolución muy bien definida en la que, si no responde a los tratamientos, lentamente se va malignizando hasta estadios con peor pronostico. Estos estadios pueden ser perfectamente monitorizados en base a los niveles de antígeno prostático especifico (PSA por sus siglas en ingles) (Figura1).

Figura 1. Historia natural del cáncer de próstata localizado. (Tomado de Cáncer de próstata. Morote et al. Medicina Clínica 2016. https://www.sciencedirect.com/science/article/pii/S002577531500041X)
Esta evolución puede derivar (aunque indicar que no siempre) en cánceres de próstata resistente a la castración (CRPC, por sus siglas en inglés) que acaban convirtiéndose en tumores polirresistentes que antes o después acaban metastatizando en otros órganos. En estos casos su supervivencia es muchísimo peor, alrededor de un 29% a los cinco años (parecida a la que presentaría el cáncer de pulmón, por ejemplo). El CRPC es un adenocarcinoma agresivo que no responde a la terapia de deprivación hormonal y origina metástasis en un 80% de los casos. Aproximadamente un 6% de los pacientes diagnosticados con cáncer de próstata evolucionarán a un CRPC metastásico. Hay que indicar también, que, aunque en un porcentaje bajo, existen también canceres de próstata que debutan ya siendo metastásicos.
La proteína HGK
HGK es una proteína kinasa, de la familia STE20 y componente de la cascada de señalización MAPKs. Bueno, expliquemos un poco esto. Las células necesitan comunicar lo que esta ocurriendo en el exterior, fuera de su membrana, al interior. Hay muchas formar de pasar y comunicar esta información, pero una de las mas exitosas es mediante “cascadas de señales”. Una cascada de señalización es, dicho de una forma muy simple, la manera en que las señales llegan de fuera de la célula al interior incluyendo el núcleo de esta. Para ello lo que sucede son una serie de reacciones química que modifican alguna proteína, que, a su vez, desencadena una modificación en otra y así sucesivamente. Es decir, una proteína se activa en respuesta a un estímulo y activa a otra, que a su vez activa a otra, que a su vez activa a otra…. Transmitiendo y amplificando la señal. Una proteína kinasa, como la HGK es una enzima que actúa fosforilando a otras proteínas, es decir, añadiendo un grupo químico denominado fosfato en un sitio específico de la proteína sobre la que actúa y que sirve como interruptor para activarlo. HGK es concretamente una serían/treonín kinasa, es decir, añade el grupo fosfato en un aminoácido que es serina o treonina. Está codificada por el gen MAP4K4 (Mitogen-Activated Protein Kinase kinase kinase kinase 4). Sin entrar en detalles complicados sobre la ruta de señalización en la que actúa HGK, sabemos que regula muchas funciones celulares, como la motilidad, proliferación, la curación de heridas… Se ha asociado niveles altos de esta proteína con adenocarcinoma de pulmón, cáncer de páncreas, carcinoma hepatocelular y tumores de cerebro y riñón. Además, también se asocia con un peor pronóstico en cáncer colorrectal, cáncer de hígado y de pulmón. También se sabe que altos niveles de la expresión del gen MAP4K4 aumentan la proliferación e invasión en cáncer de ovario y glioblastoma. La identificación de estas asociaciones entre desregulaciones de HGK y cáncer es muy importante porque nos permite hacernos una idea de la relevancia fundamental para la célula de mantener regulada a esta proteína. El mecanismo de acción por el que HGK regula estas acciones no se conoce del todo bien. Así que decidimos averiguarlo. Conocer los mecanismos moleculares de las rutas de señalización relacionadas con la migración y la invasión en cáncer de próstata nos parece muy importante, no solo para determinar nuevos marcadores de pronóstico o diagnóstico, sino también para la búsqueda de nuevas dianas terapéuticas.
¿Por qué decidimos en este trabajo estudiar esta proteína en concreto?
Porque HGK coordina muchas funciones diferentes, por lo que pensamos que puede actuar como un hub, un centro que integra señales de crecimiento con señales de estrés de tal manera que promueve la motilidad y la invasividad.
¿Cómo lo hicimos?
Lo primero que hicimos fue comparar los niveles de expresión del gen MAP4K4 (el ARN) en muestras normales y tumorales y entre muestras de un tumor primario y una metástasis. Sorprendentemente vimos que los niveles de expresión del gen MAP4K4 que codifica para la proteína HGK estaban aumentados significativamente en el caso de las muestras de pacientes que tenían metástasis. Es decir, las lesiones metastásicas tienen más expresión de este gen que los tumores primarios o el tejido normal. Esto puede ser casualidad, es decir, uno mas de los genes que están aumentados, o causalidad, es decir, de alguna manera la expresión de este gen es relevante para que se produzca la metástasis. Pero ¿Cómo?
Posteriormente analizamos la expresión del mismo gen en cuatro líneas celulares de cáncer de próstata que tienen diferente capacidad de metastatizar y vimos, de nuevo, que el gen MAP4K4 se expresaba más en las líneas celulares que tenían mayor capacidad de metástasis. Hicimos lo mismo con la proteína HGK y observamos los mismos resultados.
Hasta aquí solo son, por así decirlo, observaciones interesantes. Un gen y su correspondiente proteína está en alta cantidad en células de metástasis de cáncer de próstata, pero no en las que no suelen producir metástasis. Pero había que llegar un poco más allá, ¿Cómo se llega un poco más allá? Pues con la edición génica. La hipótesis es la siguiente, si la proteína es importante para la metástasis, si se las “quitamos” las células metastásicas deberían dejar de ser metastásicas. Así que nos pusimos manos a la obra y procedimos a “borrar” (por medio de la tecnología CRISPR) la proteína HGK en las líneas con tendencia a metástasis y estudiamos qué pasaba con la capacidad de migración y adhesión de las células. Pues bien, ambas capacidades disminuían. Es decir, parecía claro que, si no está o no funciona bien HGK, la capacidad de migración de las células de cáncer de próstata disminuye.
Se sabe también que HGK está relacionada con la proliferación de los linfocitos T y de células tumorales de pulmón y estómago. Por esto quisimos saber qué pasaba con las propiedades de crecimiento y tumorigénicas al eliminar o bloquear HGK en las células de cáncer de próstata invasivas. Observamos que la viabilidad y el crecimiento disminuía. Es decir, parece que HGK, además de importante para la migración de las células de cáncer de próstata, también lo es para su proliferación e invasión.
La migración celular y la invasión son procesos regulados por el citoesqueleto de actina, así que el paso siguiente era estudiar si la morfología, que viene definida por la actina, estaba alterada. Y, efectivamente, así era en las células sin HGK o con esta proteína inhibida. El citoesqueleto de actina es como el esqueleto óseo de la célula. La célula puede (y tiene) que montar “huesos” nuevos en la región de avance de la célula y desmontar “huesos” viejos en la región trasera de la célula. Este proceso se realiza mediante la polimerización de unidades de una proteína que se llama actina y que forma filamentos a lo largo de la célula (figura 2). Estos filamentos entran en contacto con la superficie externa de la célula a través de unas estructuras conocidas como adhesiones focales. Estas estructuras son muy dinámicas y sirven de anclaje a la vez que informan a la célula de la composición del sustrato y la dirección de movimiento.


Figura 2. Arriba. Imagen de filamentos de actina (color verde) en células en cultivo Imágenes cedidas por Sheila Castro Sánchez. Dpto. Bioquímica, Genética a Inmunología. Universidad de Vigo). Abajo. Haces de filamentos de actina formando las denominadas fibras de estrés durante el desplazamiento celular. En conjunto forman una adhesión focal. (tomado de atlas de histología vegetal y animal https://mmegias.webs.uvigo.es/5-celulas/7-actina-c.php)
Generalmente se asocia perdida de adhesión con metástasis, ya que las células epiteliales, que están adheridas necesitan despegarse de la membrana donde están para poder viajar por la sangre hasta su órgano diana. Sin embargo, las células metastásicas necesitan volver a adherirse una vez que llegan a su órgano diana y moverse hasta encontrar su nicho adecuado. De manera que más que una perdida de adhesión, lo que la células metastásicas necesitan es un proceso dinámico de adhesión que les permita moverse rápidamente.
Y es esto lo que creemos que aporta HGK a las células metastásicas. Al eliminar HGK vimos que las células pasaban a tener una forma como de “huevo frito” como consecuencia de la alteración del citoesqueleto de actina, y, además, tenemos datos que indican que no eran capaces de modificar las adhesiones focales de una manera rápida haciendo que las células sin HGK sean menos móviles y por lo tanto menos metastásicas.

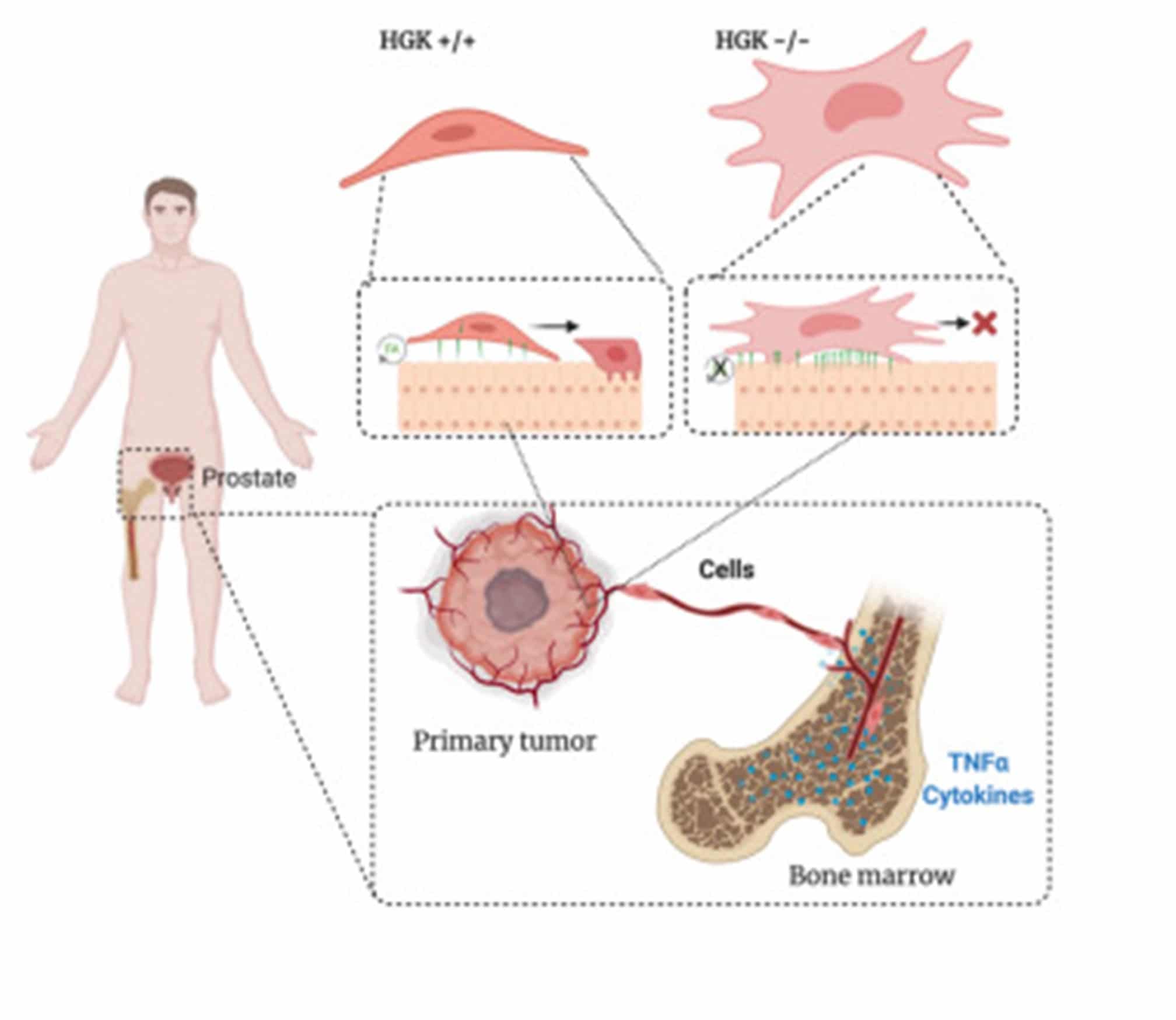
Figura 3: Arriba: Imagen de filamentos de actina en células wt o HGK-KO en cultivo. Abajo. Resumen grafico del efecto de HGK en el proceso metastásico (tomado del artículo original: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8192525/)
¿Esto que nos aporta?
Bueno, pues varias cosas: 1) por un lado aprendemos más sobre el proceso molecular de la metástasis, pero además 2) identificamos una proteína relevante en ese proceso que puede ser usada como biomarcador. ¿Qué significa esto? Pues que se puede analizar la expresión de este gen en lesiones tumorales de cáncer de próstata y (junto con otros marcadores) determinar si ese tumor va a tener tendencia a metastatizar o no. Niveles altos de HGK serían una mala señas. Pero además tenemos otra herramienta 3) es que hay inhibidores (es decir fármacos) que reducen la actividad de HGK por lo que en caso de tener niveles altos se podría combinar estos inhibidores con las terapias habituales del cáncer. Esto por supuesto, son solo elucubraciones de lo que se podría obtener a medio largo plazo.
Referencias
Artículo original: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8192525/
Atlas de histología vegetal y animal: https://mmegias.webs.uvigo.es/inicio.html
Cáncer de próstata/Prostate cáncer. Joan Morote, Xavier Maldonado, Rafael Morales-Bárrera (grupo multidisciplinario para el estudio y tratamiento del cáncer de próstata Vall d’Hebron). Medicina Clínica. Volume 146, Issue 3, 5 February 2016, Pages 121-127 https://www.sciencedirect.com/science/article/abs/pii/S002577531500041X
About the Author: Alvaro Gutierrez-Uzquiza
2 Comments
Leave A Comment Cancelar la respuesta
Este sitio usa Akismet para reducir el spam. Aprende cómo se procesan los datos de tus comentarios.







[…] Source link […]
[…] Source link […]