Cómo mantener la identidad del hígado para protegerlo
Soy María Gárate y en el post de hoy en Dciencia os quiero contar el trabajo que acabamos de publicar en la revista Hepatology, que forma parte de mi Tesis Doctoral. Este trabajo ha sido dirigido por la Dra. Carmen Berasain y la Dra. María Arechederra, y se ha llevado a cabo en el Programa de Hepatología del Centro de Investigación Médica Aplicada de la Universidad de Navarra.
¿EN QUÉ HA CONSISTIDO NUESTRO TRABAJO?
Hemos identificado nuevos mecanismos moleculares implicados en el mantenimiento de la identidad y las funciones del hígado. Estos mecanismos se alteran cuando se produce un daño en dicho órgano, favoreciendo la progresión de la enfermedad hepática. Este descubrimiento aporta una pieza nueva para poder desarrollar en un futuro nuevas terapias frente a diferentes tipos de daño hepático.
¿CÓMO FUNCIONA UN HÍGADO SANO?
El hígado tiene un papel central en el organismo, puesto que desempeña una serie de funciones esenciales para que el resto de órganos y sistemas funcionen correctamente y se mantenga un equilibrio. Entre estas funciones encontramos: el mantenimiento de los niveles de glucosa o de colesterol en sangre, la producción de nuevas proteínas como factores de coagulación o de sales biliares para la digestión de las grasas, el almacenamiento de algunas vitaminas y minerales, o la detoxificación de sustancias nocivas para favorecer su posterior eliminación del cuerpo.
En el hígado existen muchos tipos de células, pero la población más abundante son los hepatocitos. En un hígado adulto sano, estos hepatocitos raramente se dividen y se encuentran muy bien diferenciados. Os preguntaréis, ¿qué significa que “los hepatocitos estén muy bien diferenciados”? Hablamos de diferenciación celular cuando las células adquieren una forma y funciones específicas. Se trata de un proceso de maduración por el que las células se especializan en un tipo concreto de funciones y, por lo tanto, adquieren una serie de características particulares que las identifican. Sería lo que identifica a una célula del hígado (hepatocito), y la diferencia de una célula del corazón (cardiomiocito) o de una célula del sistema nervioso (neurona). Para que esto ocurra, cada tipo celular debe expresar una serie de genes y proteínas concretos. Además, algunas de estas proteínas se consideran “directores” responsables de la identidad celular ya que, jerárquicamente, controlan la expresión de otros genes y proteínas.
Para tratar de ilustrar esto, os pongo un ejemplo. Imaginemos un aeropuerto con un montón de aviones que despegan, que aterrizan, que tienen que esperar, que deben pasar por mantenimiento, que necesitan descargar mercancía, etc. A priori parecería un caos, pero se mantiene un orden y organización gracias a las torres de control, que dan las órdenes para que cada avión sepa lo que tiene que hacer. Pues en los hepatocitos de un hígado sano pasaría algo parecido: hay una serie de proteínas que son las torres de control y que regulan la expresión de otros genes, los inducen o los reprimen dependiendo de las necesidades de las células, y así los hepatocitos pueden realizar correctamente sus funciones.
¿CÓMO SE PRODUCE UN DAÑO EN EL HÍGADO?
Hablamos de daño hepático cuando sustancias nocivas que normalmente proceden del ambiente externo atacan al hígado. Podemos diferenciar dos tipos de daño hepático: agudo y crónico.
- Daño hepático agudo. Es un daño intenso, que se produce en un corto periodo de tiempo y que produce la muerte masiva de los hepatocitos. Generalmente se debe a intoxicaciones por fármacos, alcohol o toxinas presentes en alimentos. Cuando se produce un fallo hepático agudo, es necesario un trasplante de hígado para evitar la muerte del paciente.
- Enfermedad hepática crónica. Es un daño más leve pero que persiste y se acumula durante un tiempo prolongado. Es el caso de las infecciones por los virus de la hepatitis B y C, el consumo excesivo de alcohol o las enfermedades metabólicas (diabetes, obesidad). Esta enfermedad va progresando en el tiempo desde una acumulación de grasa en el hígado o esteatosis, hasta una hepatitis, cirrosis o cáncer de hígado. Estas enfermedades hepáticas crónicas causan más de 2 millones de muertes anuales a nivel mundial, y su incidencia en nuestro entorno está creciendo debido a la epidemia de obesidad.

La progresión de esta enfermedad puede durar décadas y los pacientes deben enfrentarse a la pérdida de función del hígado, sin prácticamente soluciones terapéuticas eficaces. Las investigaciones realizadas en los últimos años, tanto por nuestro grupo de investigación como por otros grupos, muestran que la pérdida de función hepática durante la progresión de la enfermedad, no solo se debe a la muerte de los hepatocitos sino también a la pérdida de su identidad debido a un proceso de des-diferenciación. Es decir, es como si en los hepatocitos, las torres de control del ejemplo anterior se pusieran en huelga: hay menos proteínas al mando o no se dan correctamente las órdenes y la regulación de los genes característicos del hepatocito, necesarios para que realicen correctamente su función, se ve alterada. Así, con un hígado incapaz de realizar sus funciones, el funcionamiento del resto de órganos se ve comprometido, y la supervivencia del paciente va a depender de la disponibilidad de un trasplante de hígado.
Y AHORA, ¿QUÉ HEMOS DESCUBIERTO?
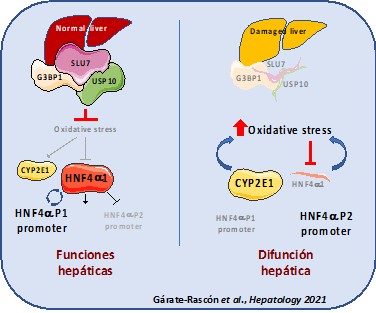
Nuestro grupo lleva años investigando una proteína que se llama SLU7. Ya descubrimos que tiene un papel muy importante para mantener las funciones del hígado sano, y que además controla la expresión de otros muchos genes (es uno de los “controladores aéreos”, master regulators de la expresión génica del hepatocito). También descubrimos que en el hígado dañado de pacientes en diferentes estadios de progresión de la enfermedad hepática esta proteína se encuentra disminuida. Por ello nos preguntamos, ¿Hay una relación entre esta disminución de SLU7 y la pérdida de función hepática que se produce durante el daño?
En este nuevo trabajo hemos utilizado ratones modificados genéticamente que expresan una cantidad reducida de la proteína SLU7, la mitad, porque portan en su genoma una única copia del gen SLU7 (ratones haploinsuficientes para SLU7; los ratones normales y nosotros portamos dos copias). Hemos descubierto que, si les inducimos daño hepático tanto agudo como crónico, se potencia la des-diferenciación de los hepatocitos y la perdida de función del hígado, y, además, se sensibiliza al hígado frente al daño. Y, ¿cómo ocurre esto? Hemos identificado que, SLU7 protege a la principal “torre de control” de los hepatocitos, una proteína llamada HNF4α. SLU7 es necesario para impedir que el estrés oxidativo (sí, ese que también hace que nos salgan arrugas en la piel o que se produzcan mutaciones y cáncer) generado en el hígado durante el daño, degrade a HNF4α. Además, hemos demostrado que, si conseguimos mantener los niveles de expresión de SLU7 durante el daño, los ratones están más protegidos porque los hepatocitos preservan mejor su función e identidad.
Así, con estos nuevos datos podemos situar a SLU7 en un nivel superior de la jerarquía de proteínas que definen la identidad hepática y preservan su función (el superintendente de las torres de control).
PERO… ¿QUÉ IMPORTANCIA TIENE CONOCER ESTOS MECANISMOS MOLECULARES? ¿CÓMO SE BENEFICIA UN PACIENTE CON DAÑO HEPÁTICO DE ESTE DESCUBRIMIENTO?
En este caso, a corto plazo un paciente no va a obtener beneficios. Sin embargo, la investigación molecular es la base para desarrollar terapias. Es fundamental conocer cómo funcionan las proteínas que regulan el organismo y cómo se alteran durante los procesos patológicos, para poder modular estas “dianas” desarrollando fármacos.
A día de hoy no disponemos de fármacos que frenen la progresión de la enfermedad hepática crónica o que permitan recuperar la función hepática en estos pacientes. Así, en la actualidad, la única estrategia curativa para estos pacientes es el trasplante hepático. Y dada la escasez de órganos, muchos pacientes fallecen en la lista de espera a consecuencia de un fallo hepático. Con este trabajo, hemos desentrañado nuevos mecanismos que son esenciales para mantener la identidad y la función hepáticas durante el daño hepático, de forma que estrategias que permitan su modulación podrían ser utilizadas con fines terapéuticos.
Podéis encontrar el artículo original en: https://doi.org/10.1002/hep.32029
Gárate-Rascón M, Recalde M, Jimenez M, Elizalde M, Azkona M, Uriarte I, Latasa MU, Urtasun R, Bilbao I, Sangro B, Garcia-Ruiz C, Fernandez-Checa JC, Corrales FJ, Esquivel A, Pineda-Lucena A, Fernández-Barrena MG, Ávila MA, Arechederra M, Berasain C. SLU7 prevents oxidative stress-mediated HNF4α degradation preserving hepatic differentiation and protecting from liver damage. Hepatology. 2021 Jun 25. doi: 10.1002/hep.32029. Epub ahead of print. PMID: 34170569.
About the Author: María Gárate
2 Comments
Leave A Comment Cancelar la respuesta
Este sitio usa Akismet para reducir el spam. Aprende cómo se procesan los datos de tus comentarios.







[…] Source link […]
[…] Source link […]